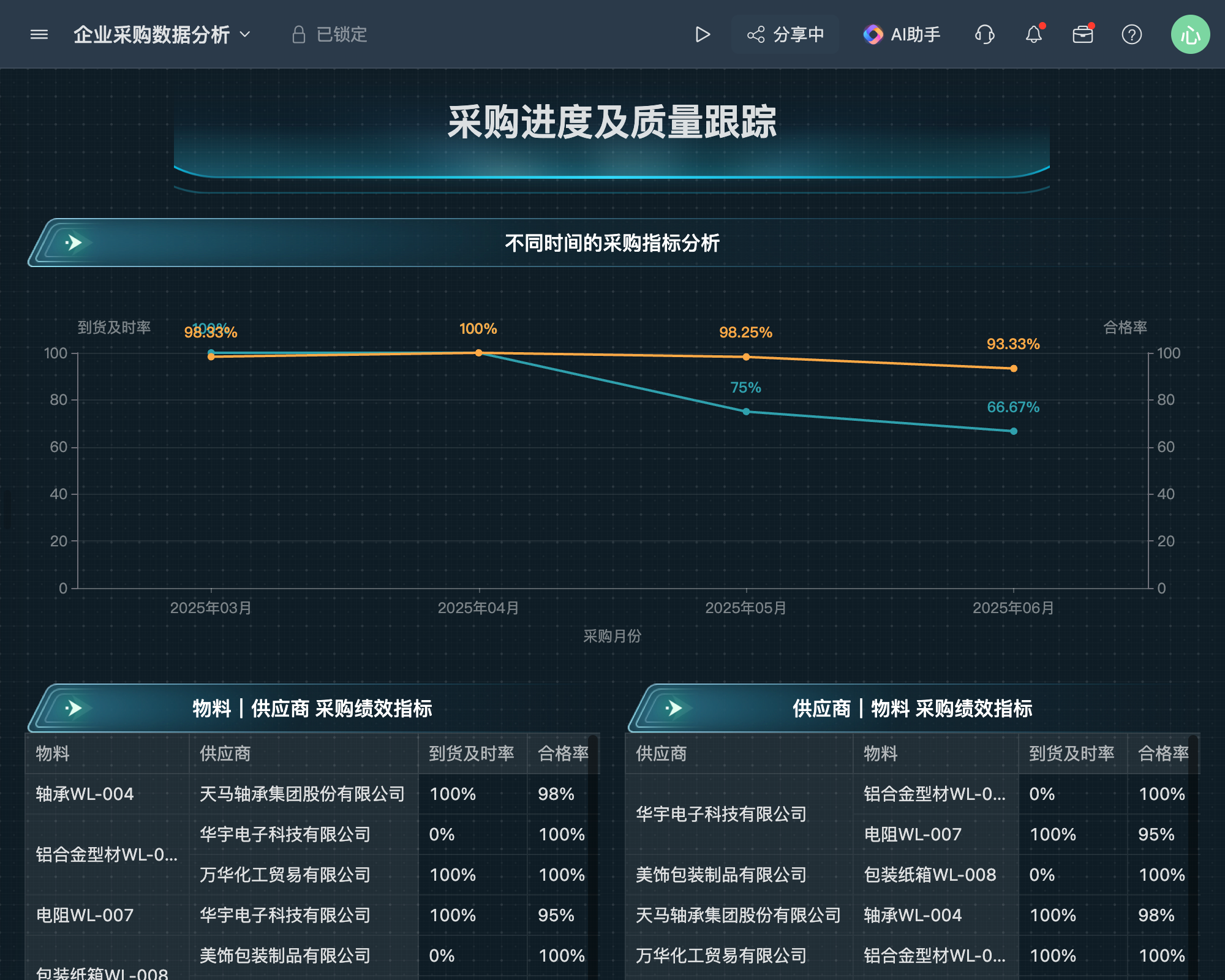
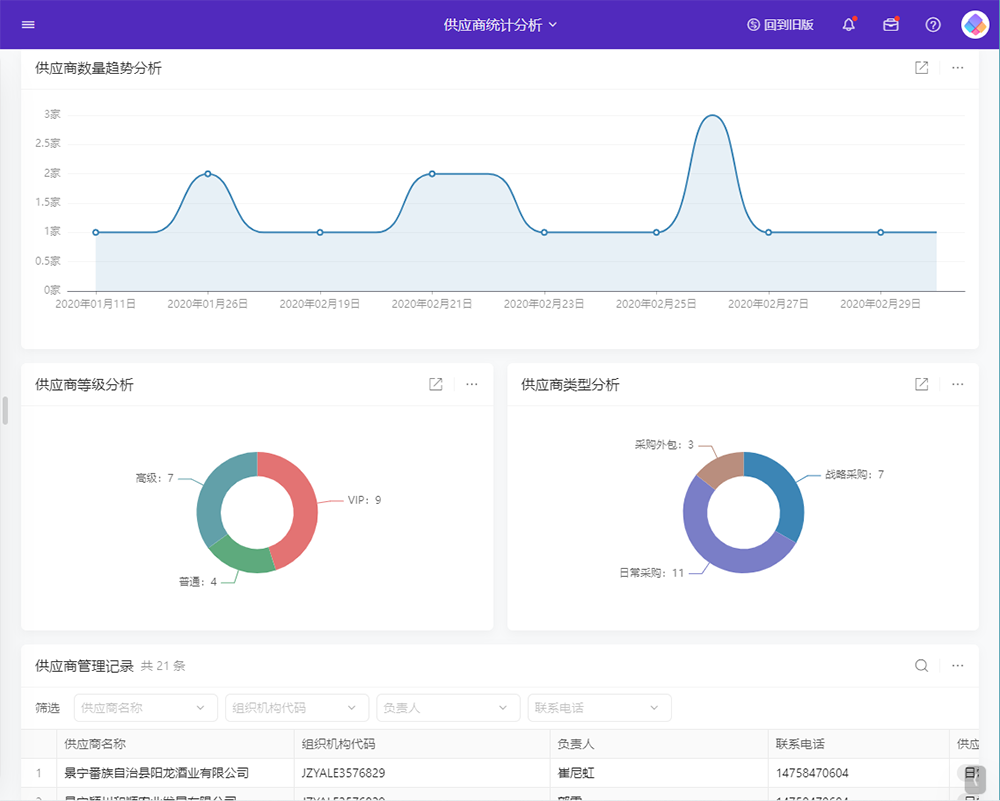
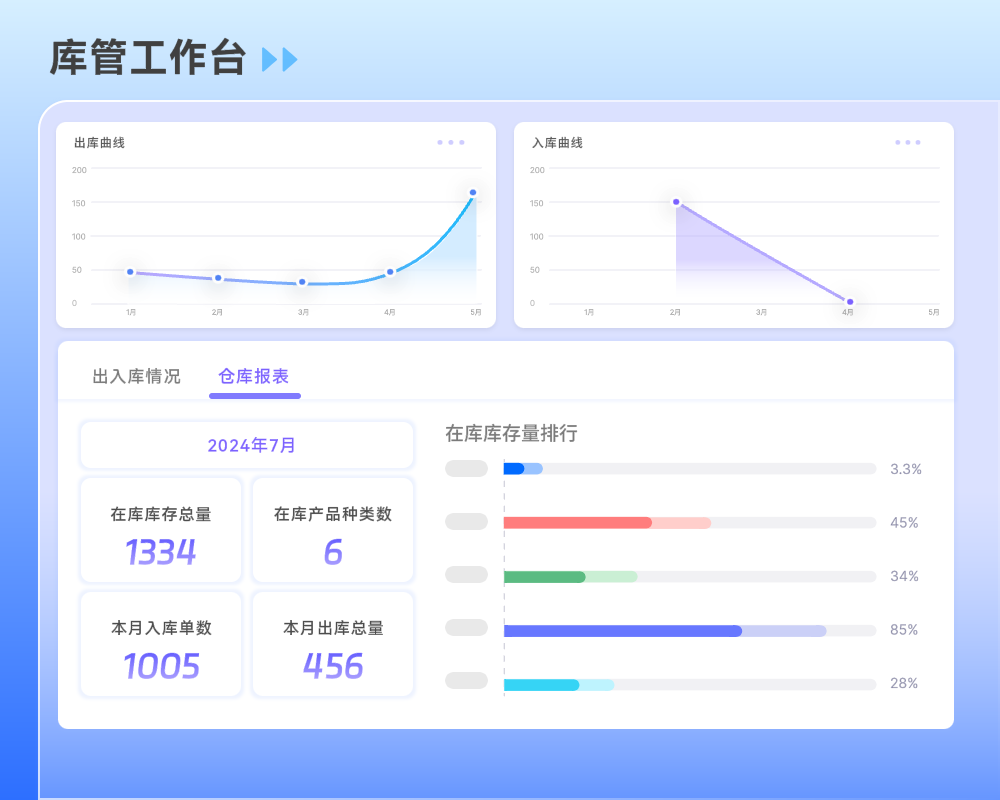
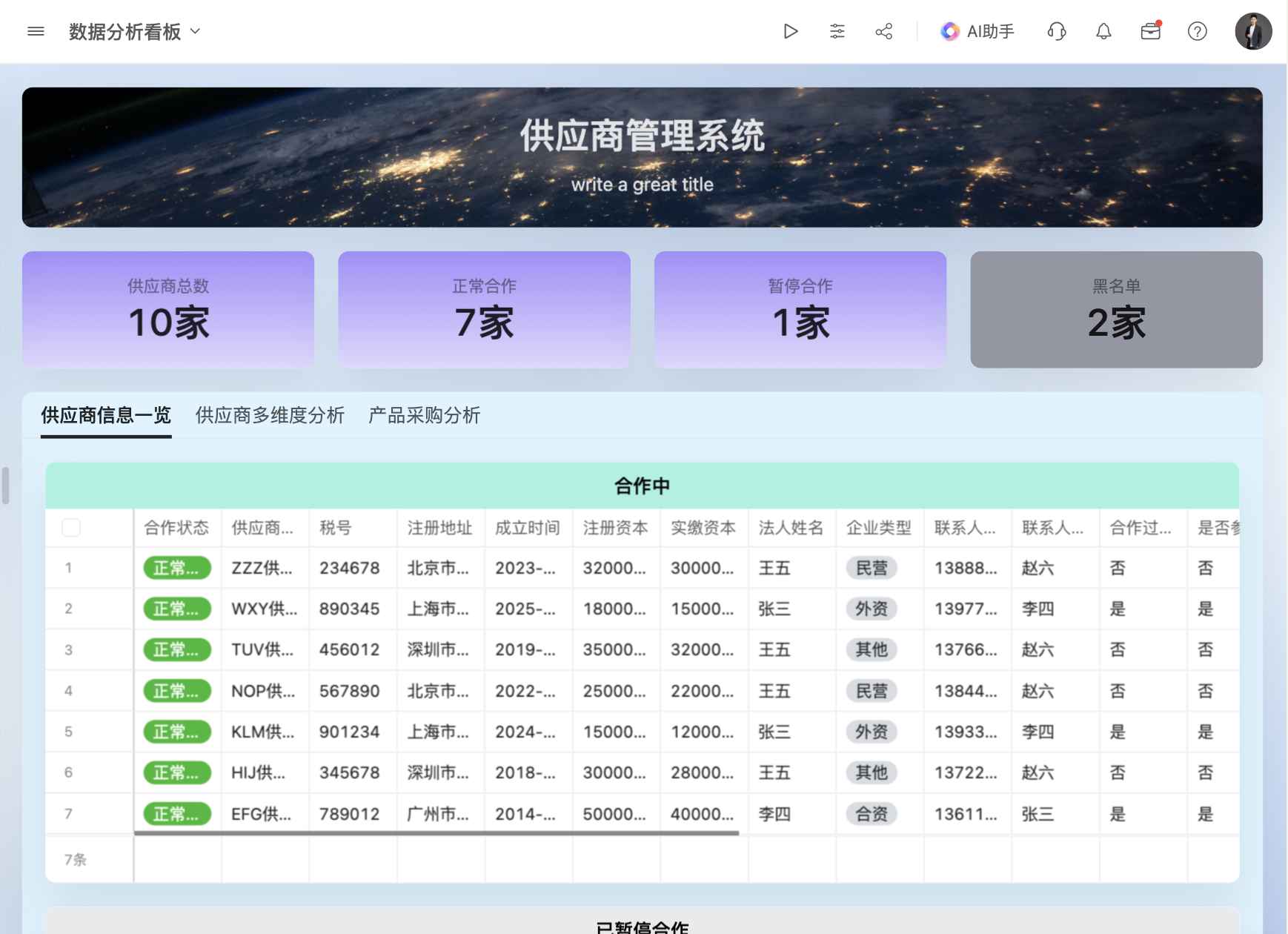
目录
医疗器械管理办法 新:全面解读对医疗各环节的重大影响
新的医疗器械管理办法已出台,它涵盖医疗器械研发、生产、销售、使用等多环节。从分类管理细化到各环节规范要求,不仅影响企业、医疗机构,也为消费者提供更多保障。想知道这其中都有哪些具体变革吗?快来深入了解一下吧。
用户关注问题
新医疗器械管理办法对企业有哪些影响?
就好比我们开了个医疗器械公司,这新的管理办法出来了,肯定会对咱公司有不少影响吧。到底都有哪些方面会受到影响呢?是生产啊,销售啊,还是别的啥?这可关系到公司的发展啊。
新医疗器械管理办法对企业有着多方面的影响。从生产角度来看,可能会加强质量管控标准,例如更严格的原材料审核、生产流程监控等,这有助于提升产品质量,但也可能增加成本。在销售方面,可能规范销售渠道与宣传推广内容,减少虚假宣传风险,同时提高市场准入门槛,竞争环境或许更加有序。对于企业来说,既是机遇也是挑战。一方面,可以淘汰一些不规范的竞争对手;另一方面,如果自身不能适应新规定,可能面临合规风险。如果您想深入了解如何让企业更好地适应新医疗器械管理办法,欢迎点击免费注册试用我们的咨询服务,我们将为您详细解读并提供应对策略。

新医疗器械管理办法在保障患者安全方面有什么新举措?
咱们患者去医院用医疗器械的时候,心里都盼着这些器械都是安全可靠的。那这个新的管理办法,在保证我们患者安全这块,有没有啥新的办法呀?比如说是不是对器械的检测更严了之类的?
新医疗器械管理办法在保障患者安全方面有诸多新举措。首先,在医疗器械的上市前审批环节,会强化临床试验的监管,确保数据真实可靠,只有经过严格验证安全有效的器械才能进入市场。其次,在使用环节,可能要求医疗机构加强对医疗器械的日常维护和监测,并且建立完善的不良事件报告机制,一旦发现器械存在安全隐患能及时处理。再者,对医疗器械的召回制度也会更加完善,能够快速响应,防止不安全的器械继续使用。总之,新办法全方位地关注患者安全。如果您希望进一步了解医疗器械安全知识以及如何监督其安全性,可预约演示我们的相关课程。
如何依据新医疗器械管理办法开展质量管理工作?
我在医疗器械厂负责质量管理,现在出了新的管理办法,我有点懵,不知道该咋根据这个新办法来把质量管理工作做好。是得重新制定流程吗?还是咋做呢?
依据新医疗器械管理办法开展质量管理工作,可从以下几个关键步骤着手。第一步,深入学习新办法中的质量标准和要求,与旧标准对比找出差异点。第二步,根据差异调整现有的质量管理体系,比如质量手册、程序文件等。如果涉及到人员操作规范的改变,要及时对员工进行培训。第三步,加强对供应商的管理,因为原材料质量也是整体质量的重要一环。第四步,建立内部审核和监督机制,定期检查质量管理工作是否符合新办法的要求。从SWOT分析来看,优势在于新办法为质量管理提供了明确方向和标准,劣势可能是企业需要投入资源去适应变革;机会是借此提升企业形象和竞争力,威胁则是如果不能及时适应可能面临处罚。如果您想获取更多质量管理工具和模板来适应新医疗器械管理办法,欢迎点击免费注册试用我们的质量管理辅助软件。
新医疗器械管理办法下,小型医疗器械企业的生存之道是什么?
我开了个小的医疗器械厂,这新的管理办法一出来,感觉压力山大啊。我们这种小企业资金有限、人手不足,该怎么在这个新规定下活下去呢?有没有啥好办法呀?
在新医疗器械管理办法下,小型医疗器械企业的生存之道需要从多方面考虑。从自身优势(Strengths)来看,小型企业灵活性高,可以快速调整业务方向。首先,集中精力做好某一细分领域的产品,做到精而专,避免与大型企业在全品类上竞争。例如,专注于某类特色的家用医疗器械。其次,积极寻求合作机会,可与其他企业联合进行研发或共享资源,降低成本。然而,也要看到劣势(Weaknesses),如资金和人力有限。所以要合理分配资源,优先满足新办法中的核心要求。机会(Opportunities)方面,新办法可能促使市场更加规范,小企业可以凭借优质产品脱颖而出。威胁(Threats)则是如果不能满足新要求可能被淘汰。总之,小企业要充分利用自身优势,抓住机会,弥补劣势,规避威胁。如果您想了解更多适合小型企业的发展策略,欢迎预约演示我们专门为小型医疗器械企业打造的咨询方案。
免责申明:本文内容通过 AI 工具匹配关键字智能整合而成,仅供参考,伙伴云不对内容的真实、准确、完整作任何形式的承诺。如有任何问题或意见,您可以通过联系 12345@huoban.com 进行反馈,伙伴云收到您的反馈后将及时处理并反馈。
热门场景应用