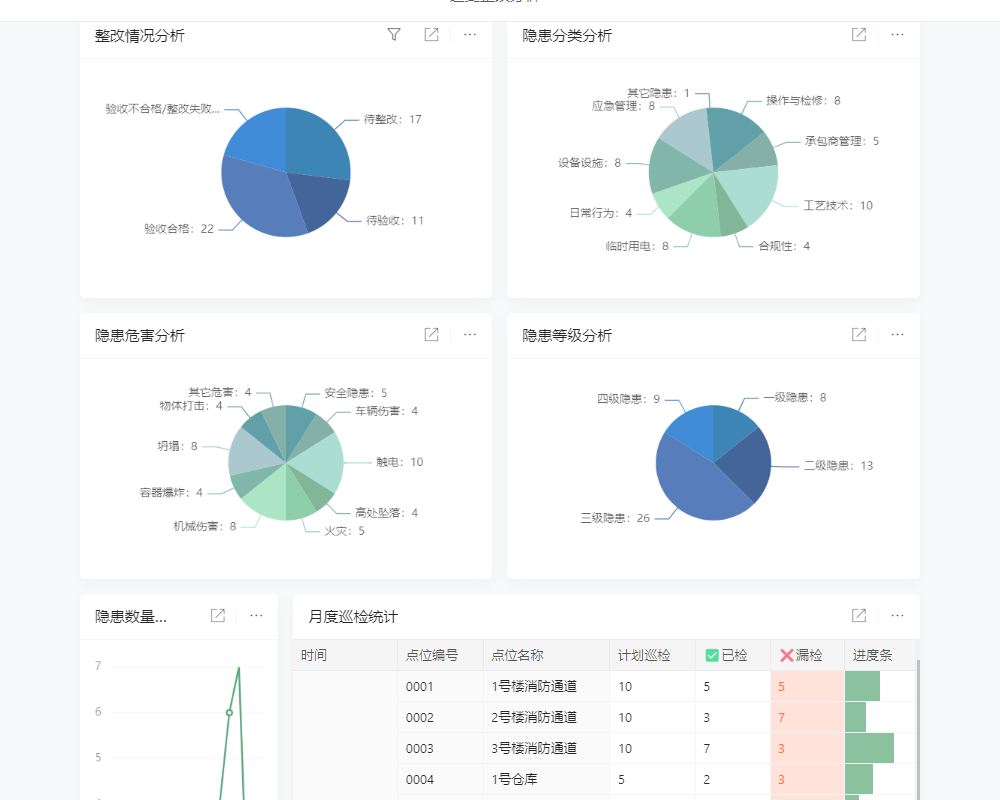
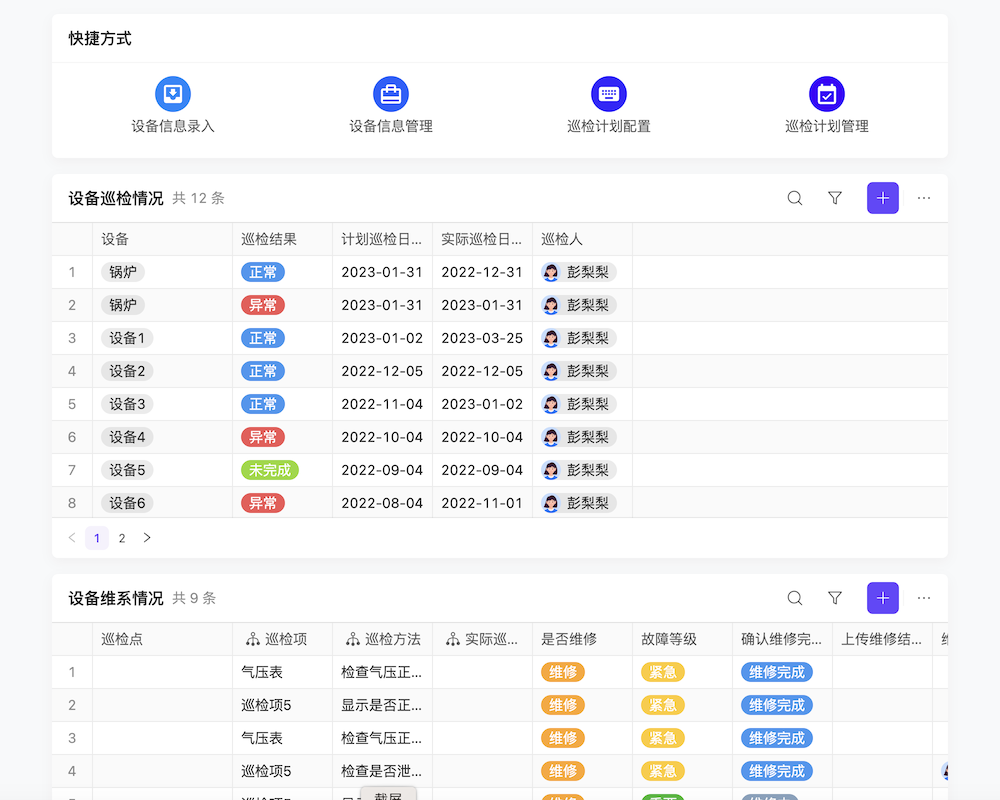
目录
医疗器械产品灭菌认证管理办法全解析
全面了解医疗器械产品灭菌认证的重要性、流程及管理办法,确保患者安全,提升产品竞争力。通过合规管理,轻松应对国内外市场挑战。点击免费注册试用/预约演示,助您顺利通过灭菌认证!
用户关注问题
医疗器械产品如何进行灭菌认证管理?
就是说,咱们生产的医疗器械要上市,得经过灭菌认证这一关,那具体该怎么操作管理呢?
医疗器械产品的灭菌认证管理是一个系统而严谨的过程。首先,企业需要明确所生产医疗器械的灭菌方式和要求,确保产品符合相关法规标准。接下来,按照《医疗器械产品灭菌认证管理办法》的规定,提交必要的申请材料,包括产品说明书、灭菌验证报告等。
在申请过程中,企业还需配合监管部门的现场审核,确保生产环境和流程符合灭菌要求。审核通过后,将获得灭菌认证证书,这是产品上市销售的重要凭证。此外,企业还需定期接受监督审核,确保持续符合灭菌认证标准。为了更深入地了解这一过程,您可以点击免费注册试用我们的医疗器械管理软件,它将助您高效管理灭菌认证等关键环节。

医疗器械灭菌认证管理办法的主要内容有哪些?
想了解下,这个管理办法具体都规定了些什么?对我们企业有哪些要求?
《医疗器械产品灭菌认证管理办法》主要包括了医疗器械灭菌认证的申请、审核、批准、监督等方面的规定。它要求企业建立完善的灭菌管理体系,确保产品从生产到销售的每一个环节都符合灭菌标准。同时,该办法还明确了监管部门的职责和权限,为灭菌认证的顺利实施提供了法律保障。
对于企业而言,需要认真学习并遵守这些规定,确保产品符合灭菌要求,提升市场竞争力。此外,通过预约演示我们的医疗器械管理软件,您可以更直观地了解如何将这些规定融入到日常管理中,提高工作效率。
医疗器械灭菌认证不通过的原因有哪些?
要是申请灭菌认证没通过,可能是什么原因造成的呢?
医疗器械灭菌认证不通过的原因可能多种多样。常见的原因包括:申请材料不完整或不符合要求、产品灭菌效果不达标、生产环境或流程存在缺陷等。此外,如果企业在申请过程中未能积极配合监管部门的审核工作,也可能导致认证不通过。
为了避免这些问题,企业需要在申请前充分了解《医疗器械产品灭菌认证管理办法》的要求,确保申请材料齐全、准确。同时,加强内部管理,提升产品质量和生产效率。如有需要,您可以点击免费咨询我们的专业顾问,获取更具体的指导和帮助。
医疗器械灭菌认证的有效期是多久?到期后如何续延?
灭菌认证不是一次性的吧?那它有效期是多久?到期后该怎么办?
医疗器械灭菌认证的有效期通常为几年不等,具体取决于认证机构和产品类型。到期后,企业需要重新提交申请材料,经过审核合格后方可续延认证。在续延过程中,企业需要提供过去几年内产品的灭菌效果监测报告、生产环境变更情况等资料。
为了确保灭菌认证的顺利续延,企业需要持续关注相关法规标准的变化,及时调整生产和管理流程。同时,利用我们的医疗器械管理软件可以帮助您高效管理认证资料,确保续延申请的顺利进行。如有任何疑问或需要帮助,请随时联系我们的专业团队。
免责申明:本文内容通过 AI 工具匹配关键字智能整合而成,仅供参考,伙伴云不对内容的真实、准确、完整作任何形式的承诺。如有任何问题或意见,您可以通过联系 12345@huoban.com 进行反馈,伙伴云收到您的反馈后将及时处理并反馈。
热门场景应用