目录
医疗器械风险管理适用于哪些关键环节?如何确保全过程安全可控?
楚耀辉
·
2025-05-17 02:43:56
阅读6分钟
已读2568次
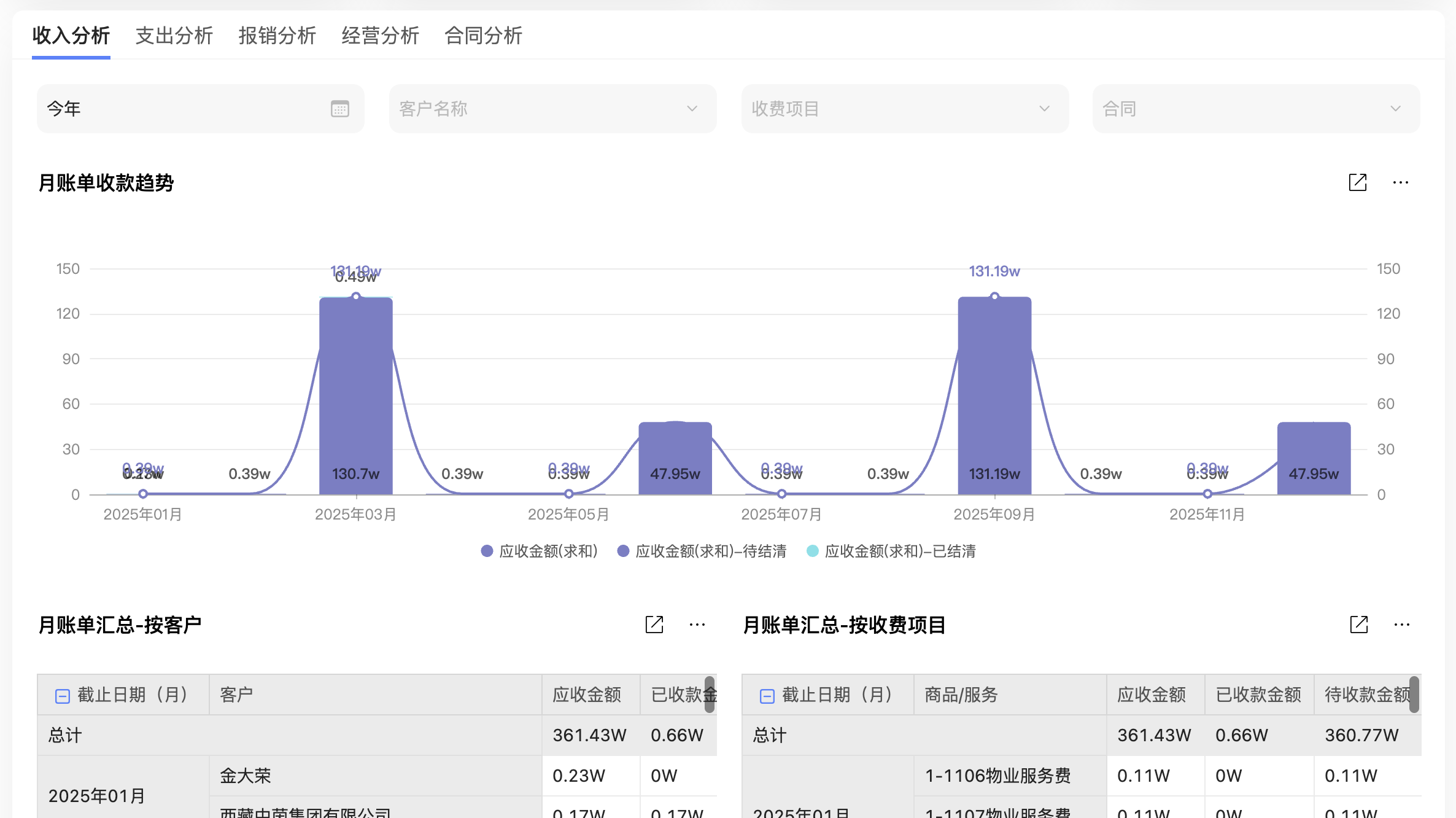
医疗器械风险管理适用于从研发到报废的整个生命周期,包括设计与开发、生产制造、市场投放及退役报废阶段。通过系统化方法识别、评估、控制和监控风险,可显著降低不良事件发生率,保障患者安全并减少企业经济损失。文章还介绍了核心要素、挑战及解决方案,以及数字化转型对风险管理的助力作用。
用户关注问题
医疗器械风险管理适用于哪些企业或组织?
假如您是一家医疗器械生产企业的负责人,您可能会疑惑:到底哪些类型的企业或组织需要进行医疗器械风险管理呢?
医疗器械风险管理适用于以下几类企业或组织:
- 医疗器械制造商: 包括生产诊断、治疗和监测设备的企业,如CT机、血糖仪等。
- 医疗器械经销商和服务提供商: 虽然不直接生产,但这些企业也需对所销售或服务的器械进行风险评估。
- 医院及医疗机构: 使用医疗器械的机构也需要确保器械使用的安全性。
- 科研机构: 开发新型医疗器械的研究团队同样需要考虑风险管理。
如果您希望进一步了解如何针对您的企业定制风险管理方案,欢迎点击免费注册试用我们的平台,或预约演示了解更多细节。

医疗器械风险管理适用于哪些阶段?
作为一名医疗器械工程师,您是否好奇:风险管理是不是只在产品设计阶段才需要关注呢?还是它贯穿于整个产品生命周期?
医疗器械风险管理适用于多个关键阶段:
- 设计与开发阶段: 识别潜在风险并采取预防措施。
- 生产阶段: 确保生产工艺不会引入新的风险。
- 上市后阶段: 收集使用反馈,持续改进产品安全性能。
- 报废阶段: 处理废弃器械时也要注意环境和健康风险。
通过全生命周期的风险管理,可以有效降低不良事件的发生率。建议您尝试我们的风险管理工具,点击免费注册试用,体验一站式的解决方案。
医疗器械风险管理适用于哪些法规要求?
假设您是合规部门的一员,面对复杂的国际法规,您可能想知道:风险管理到底需要满足哪些法规标准呢?
医疗器械风险管理需符合以下主要法规和标准:
| 法规/标准 | 适用范围 |
|---|---|
| ISO 14971 | 全球通用的医疗器械风险管理标准 |
| 21 CFR Part 820 | 美国FDA对医疗器械质量体系的要求 |
| MDD (Medical Device Directive) | 欧盟旧版医疗器械指令 |
| MDR (Medical Device Regulation) | 欧盟新版医疗器械法规 |
为确保您的产品符合相关法规,我们提供专业的风险管理服务。点击免费注册试用或预约演示,获取更多支持。
免责申明:本文内容通过 AI 工具匹配关键字智能整合而成,仅供参考,伙伴云不对内容的真实、准确、完整作任何形式的承诺。如有任何问题或意见,您可以通过联系 12345@huoban.com 进行反馈,伙伴云收到您的反馈后将及时处理并反馈。
热门内容
推荐阅读
最新内容
用零代码轻松搭建,在⼀个平台上管理所有业务
超多模板 开箱即用
能陪你创业,也能陪你上市
300万用户都在使用伙伴云,他们在竞争中脱颖⽽出
成为每个组织数字化历程中最值得信赖的伙伴
服务千行百业,值得您信赖