目录
医疗器械新规二类管理全面解析:挑战与机遇并存
医疗器械新规二类管理详解,包括注册备案、生产质控、经营使用等关键环节。新规带来哪些挑战与机遇?如何提升企业竞争力?本文全面剖析,助您应对变化,保障患者安全,推动产业发展。
用户关注问题
医疗器械新规二类管理具体包含哪些内容?
听说最近医疗器械行业有了新的二类管理规定,具体是管啥的?有哪些新的要求和变化呢?
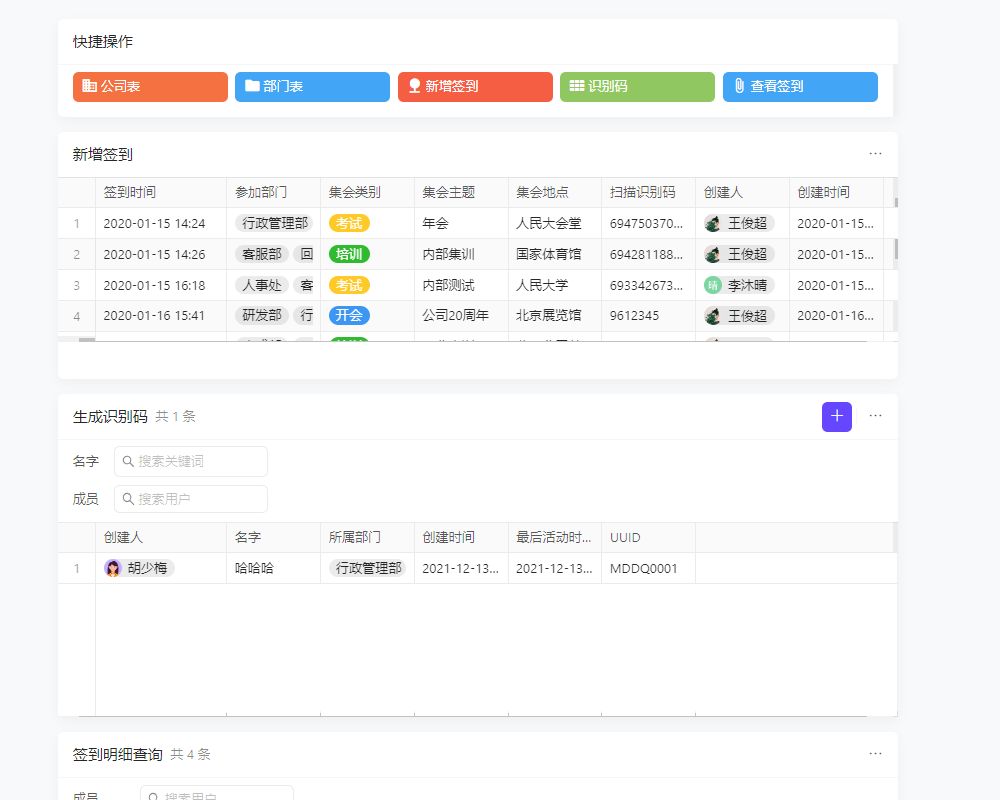
医疗器械新规二类管理主要涵盖了二类医疗器械的生产、经营、使用及监管等多个方面。具体来说,包括了对产品注册、生产许可、质量管理体系、产品追溯、不良事件监测与报告等一系列流程的严格规定。这些新规旨在提升二类医疗器械的安全性和有效性,保障公众健康。想要更深入了解这些新规的具体内容,您可以点击我们的平台免费注册试用,获取最新的法规解读和应对策略。
从SWTO分析来看,新规的实施对于行业而言,既是挑战也是机遇。企业需要加强内部管理,提升产品质量,以应对更严格的监管要求;同时,也可以借此机会进行产业升级,提升市场竞争力。

企业如何应对医疗器械新规二类管理的要求?
我们公司是做二类医疗器械的,这新规一出,我们得咋应对啊?有啥具体的建议不?
面对医疗器械新规二类管理的要求,企业可以从以下几个方面进行应对:首先,要及时了解并熟悉新规的具体内容,确保企业各项操作符合法规要求;其次,要加强内部管理,完善质量管理体系,提升产品质量;此外,还要加强员工培训,提高员工的法规意识和操作技能。通过这些措施,企业可以更好地适应新规要求,确保业务的稳健发展。如果您需要更具体的指导,欢迎预约我们的演示服务,我们将为您提供详细的解决方案。
医疗器械新规二类管理对中小企业有何影响?
我们是家小型的二类医疗器械企业,这新规对我们影响大不大?有啥利弊呢?
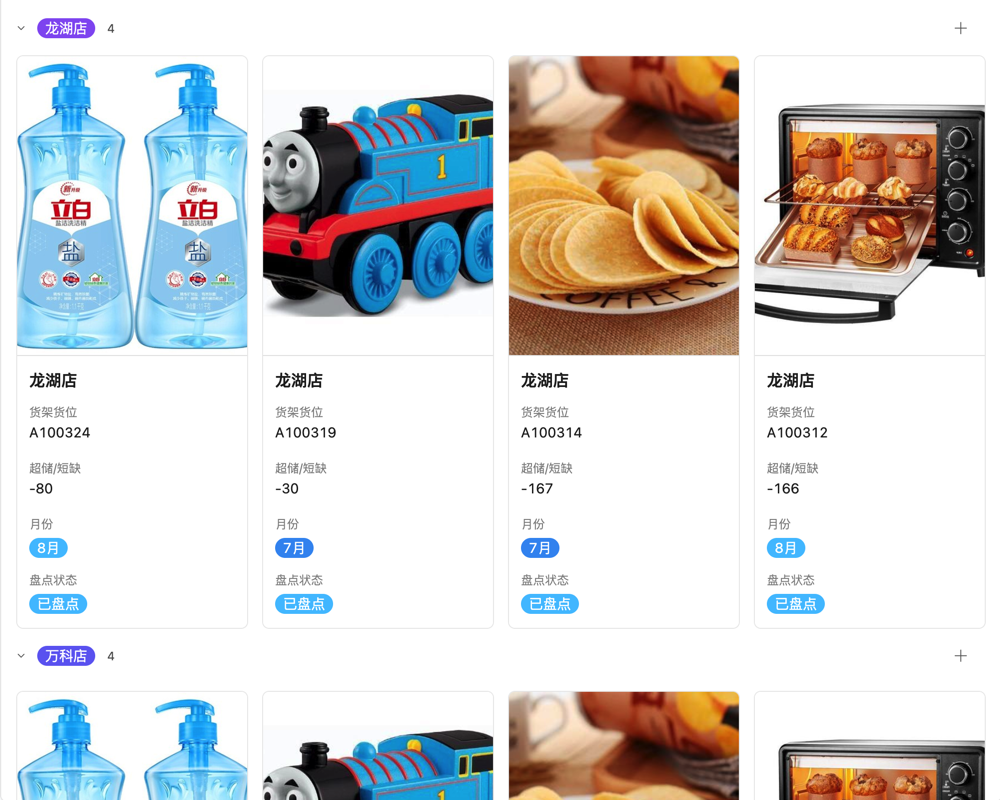
医疗器械新规二类管理对中小企业的影响是显著的。一方面,新规的实施提高了行业门槛,对于中小企业而言,需要投入更多的资源和精力来符合法规要求,这无疑增加了企业的运营成本;另一方面,新规也促进了行业的规范化发展,有利于提升中小企业的品牌形象和市场竞争力。因此,中小企业需要辩证地看待新规的影响,积极应对挑战,把握机遇。为了帮助您更好地应对新规挑战,我们提供了一系列专业的咨询服务,欢迎随时联系我们。
医疗器械新规二类管理实施后,企业如何确保产品合规?
新规实施后,我们怎么保证我们的二类医疗器械产品是合规的呢?有啥具体的方法吗?
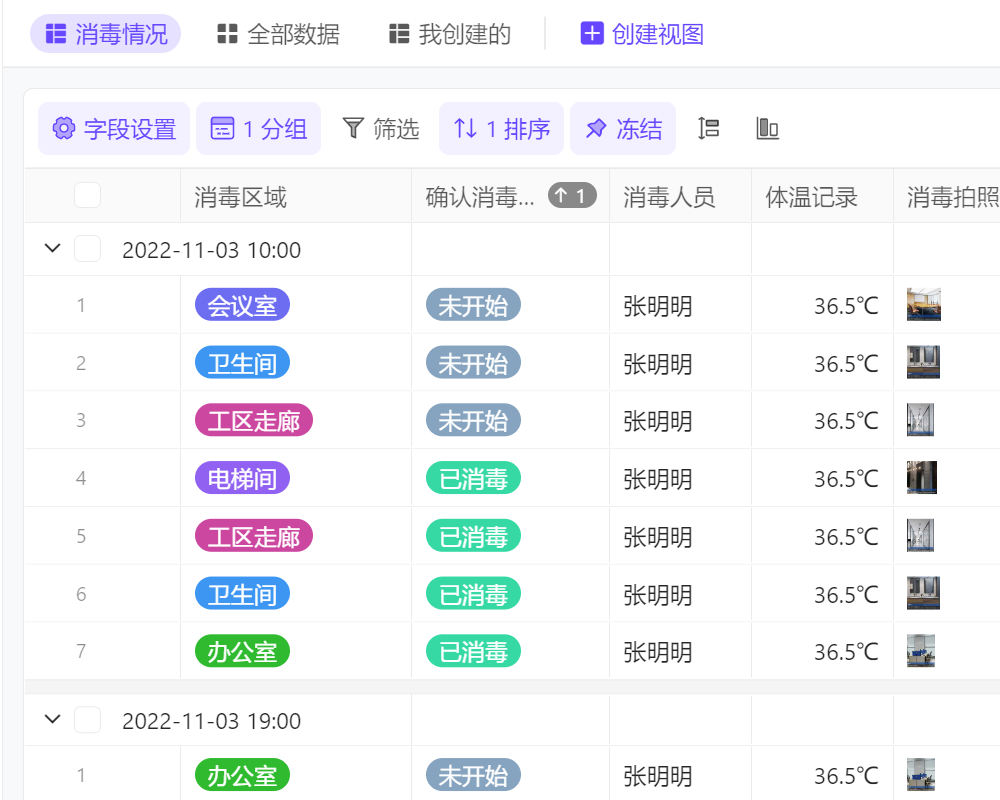
医疗器械新规二类管理实施后,企业可以通过以下几个方面来确保产品合规:一是加强产品设计和研发阶段的管理,确保产品符合法规要求;二是完善生产过程中的质量控制体系,提升产品质量;三是加强产品上市后的监测和评估工作,及时发现并处理潜在的安全风险。此外,企业还可以积极与监管部门沟通合作,获取最新的法规信息和指导建议。为了确保您的产品合规性,我们提供专业的法规咨询和检测服务,助您轻松应对新规挑战。
免责申明:本文内容通过 AI 工具匹配关键字智能整合而成,仅供参考,伙伴云不对内容的真实、准确、完整作任何形式的承诺。如有任何问题或意见,您可以通过联系 12345@huoban.com 进行反馈,伙伴云收到您的反馈后将及时处理并反馈。