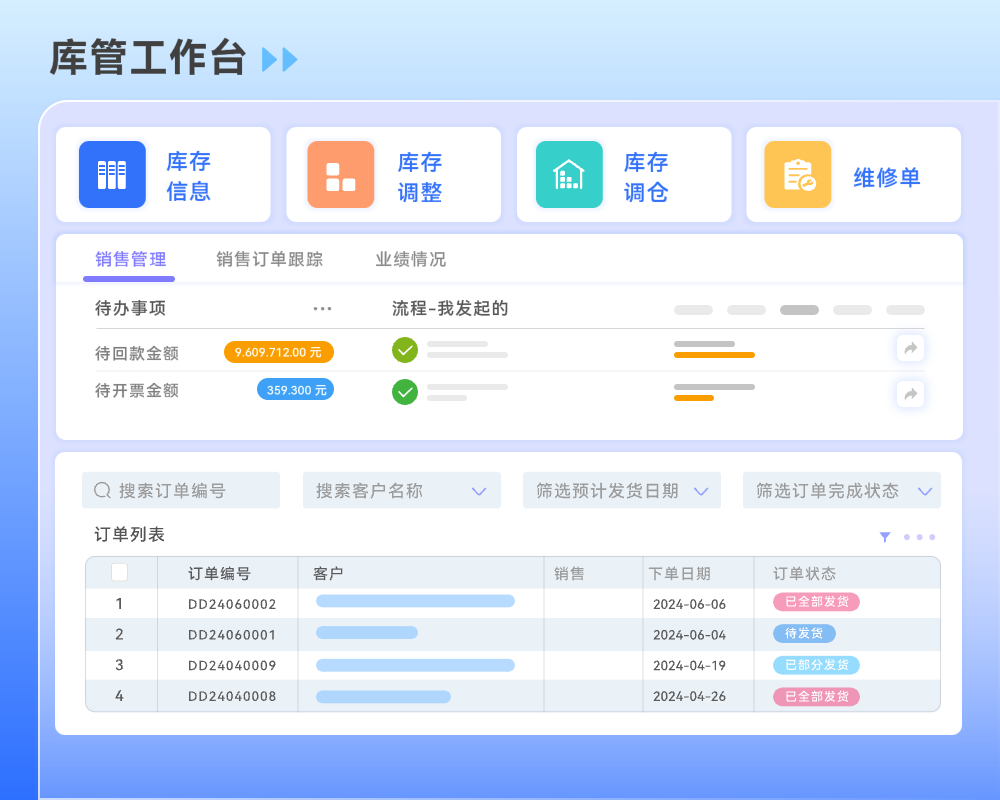
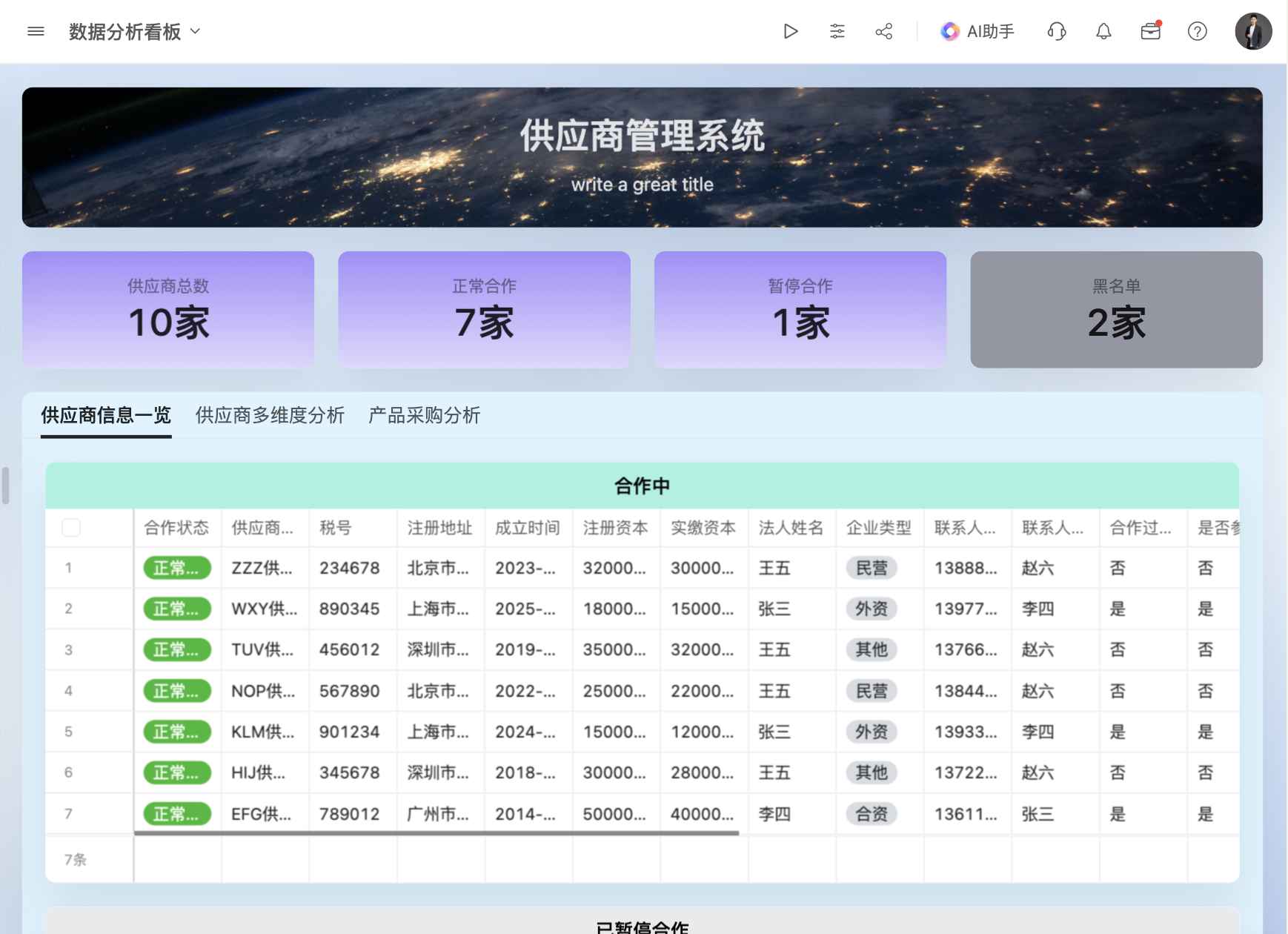
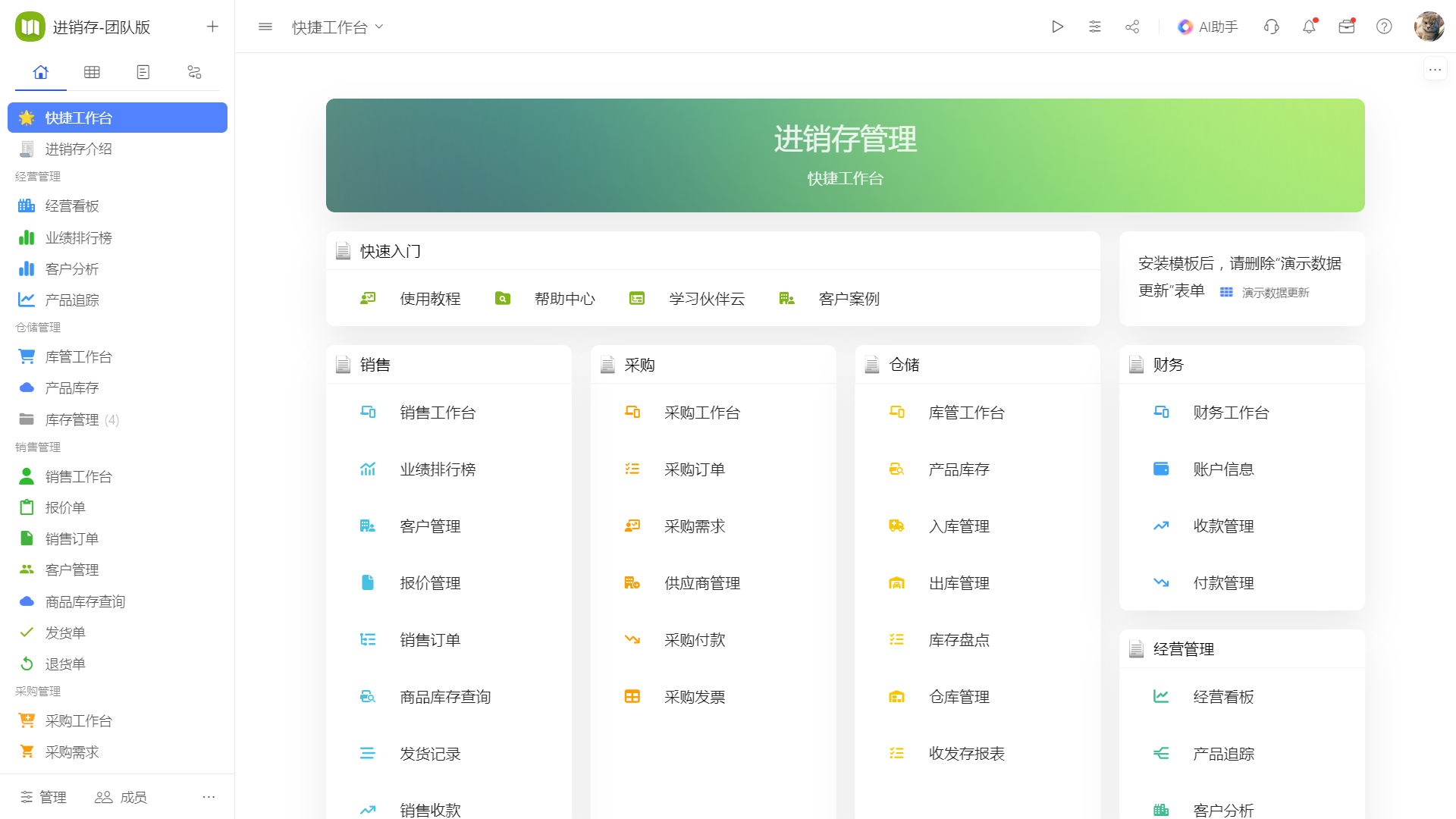
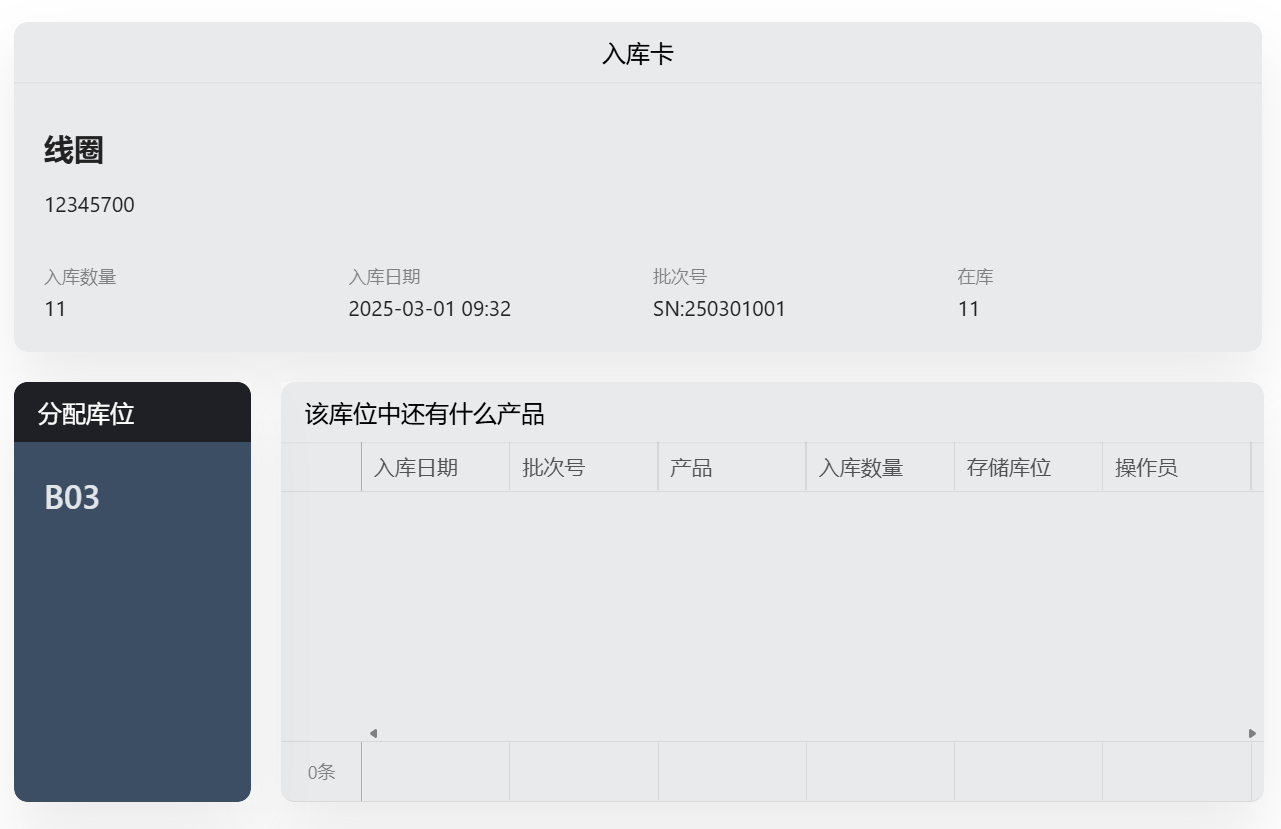
目录
如何理解美国医疗器械管理机构的作用与影响?
在全球医疗技术快速发展的背景下,美国医疗器械管理机构(FDA)作为保障安全与创新的关键力量备受关注。本文深入解析FDA的运作机制、法规框架及对全球医疗行业的深远影响,帮助您全面了解这一核心体系。
用户关注问题
美国医疗器械管理机构的主要职责是什么?
比如,您想知道美国的FDA(食品药品监督管理局)在医疗器械管理方面具体负责哪些工作?这些工作对医疗器械企业有哪些影响呢?
美国医疗器械管理机构(如FDA)的主要职责包括:
1. 审批与监管: 确保所有医疗器械在上市前经过严格的安全性和有效性评估。
2. 风险分级管理: 根据医疗器械的风险等级将其分为I类、II类和III类,并采取不同的监管措施。
3. 市场监控: 对已上市的医疗器械进行持续监测,确保其在整个生命周期内符合安全标准。
4. 不良事件报告: 要求制造商和医疗机构及时上报任何可能导致严重伤害或死亡的不良事件。
对于医疗器械企业来说,了解FDA的职责可以帮助您更好地规划产品开发流程。如果您想深入了解如何满足FDA的要求,可以点击免费注册试用我们的合规管理工具,获得专业指导。

美国医疗器械管理机构如何分类医疗器械?
假设您是一家医疗器械公司的产品经理,想知道美国FDA是如何对医疗器械进行分类的,以便更好地设计符合要求的产品。
美国医疗器械管理机构(如FDA)将医疗器械分为以下三类:
1. I类器械: 风险较低,仅需遵守一般控制(如质量体系规范)。
2. II类器械: 风险中等,除了基本控制外,还需要特殊控制(如性能标准、上市前通知510(k))。
3. III类器械: 高风险器械,通常需要通过严格的上市前批准(PMA)程序。
分类依据主要取决于器械的预期用途及潜在风险。正确理解分类规则有助于企业制定更高效的合规策略。我们建议您预约演示,以了解如何利用我们的平台优化您的分类流程。
美国医疗器械管理机构的审批流程是怎样的?
如果您是一名医疗器械工程师,正在开发一款新产品,并希望了解FDA的审批流程,从而为您的项目做好准备。
FDA的审批流程根据器械类别有所不同,以下是常见的两种路径:
1. 510(k)申请: 适用于大多数II类器械,要求证明新器械与已上市器械实质等同。
2. PMA(上市前批准): 适用于高风险III类器械,需要提供详尽的临床数据以证明其安全性和有效性。
无论选择哪种路径,都建议提前准备充分的文件资料,以加快审批速度。我们提供的合规管理解决方案能够帮助您高效整理和提交所需材料。欢迎点击免费注册试用,体验便捷的服务。
免责申明:本文内容通过 AI 工具匹配关键字智能整合而成,仅供参考,伙伴云不对内容的真实、准确、完整作任何形式的承诺。如有任何问题或意见,您可以通过联系 12345@huoban.com 进行反馈,伙伴云收到您的反馈后将及时处理并反馈。
热门场景应用