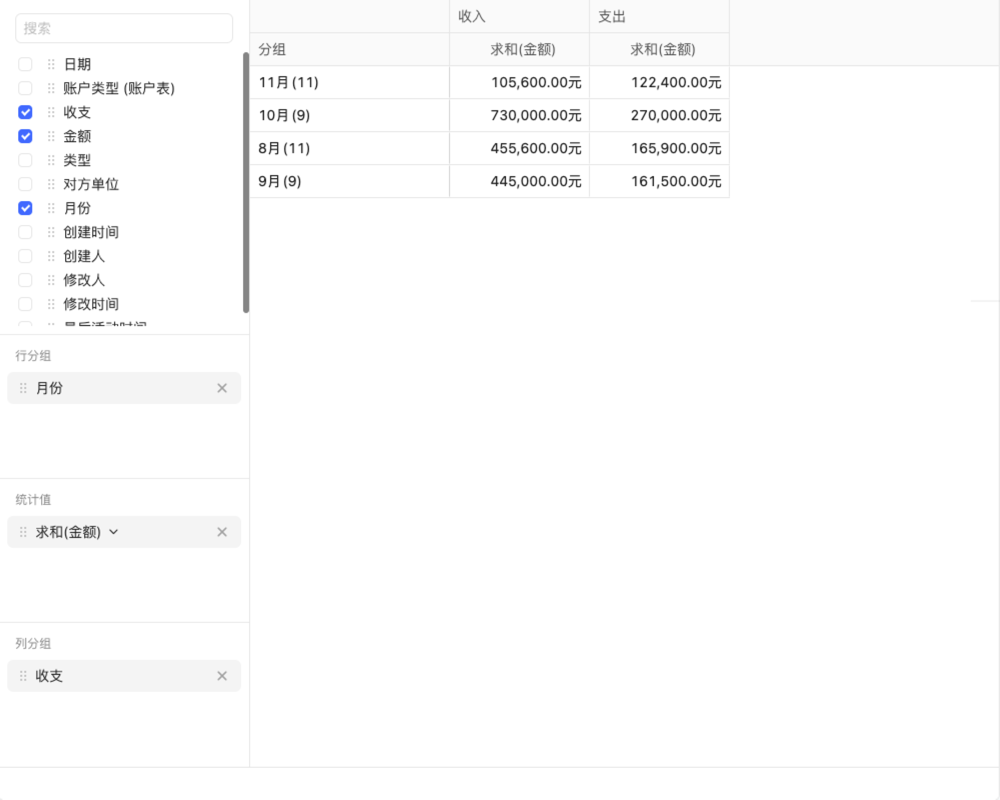
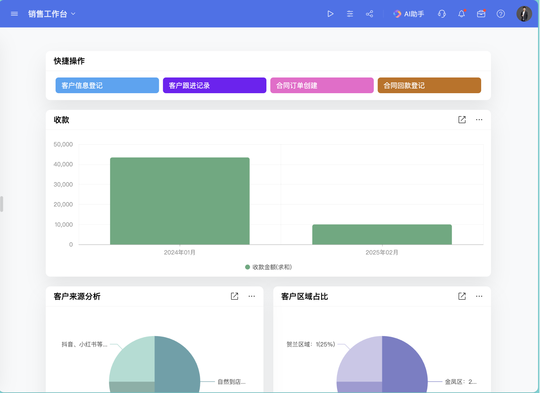
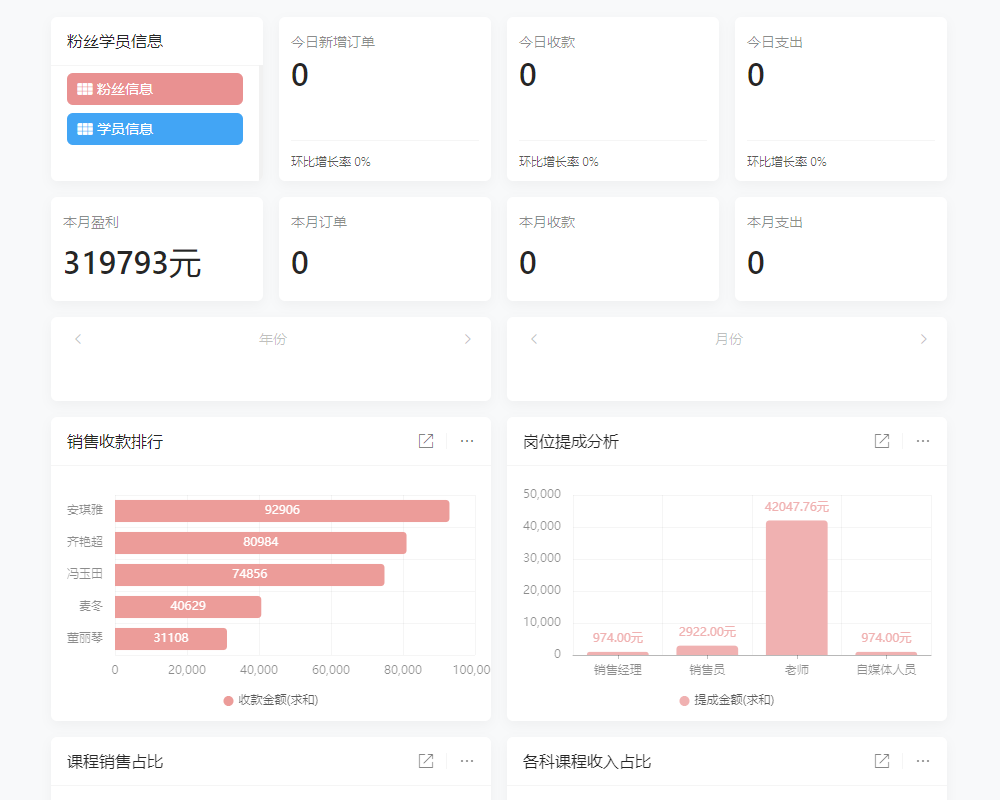
目录
中美医疗器械管理区别全面解析,助您精准把握两国监管差异
本文深入剖析中美医疗器械管理的监管框架、注册审批、市场监督及创新激励等方面区别,揭示美国FDA与中国NMPA的不同侧重点。了解两国监管差异,助力医疗器械企业精准把握市场脉搏,开拓国内外市场。点击免费注册试用或预约专业演示,获取更多专业解读和案例分析!
用户关注问题
中美医疗器械管理有哪些核心区别?
嘿,你知道吗?在医疗领域,中美两国的医疗器械管理可是有不少差异的。我就在想,这些区别到底是什么呢?比如审批流程、监管力度这些方面。
中美医疗器械管理的核心区别确实值得深入探讨。首先,从审批流程上看,美国采用的是上市前通知(510(k))和上市前批准(PMA)制度,强调风险分级管理;而中国则实行注册和备案制度,对医疗器械进行更为细致的分类管理。其次,监管力度上,美国FDA对医疗器械的监管较为严格,强调全生命周期管理;而中国则由国家药品监督管理局负责,近年来也在不断加强事中事后监管。此外,两国在法规更新、市场准入等方面也存在差异。这些区别使得中美两国在医疗器械的安全性、有效性保障上各有千秋。如果您对中美医疗器械管理感兴趣,不妨点击我们的免费注册试用链接,了解更多详情。

为什么中美医疗器械管理会有这些不同?
我一直很好奇,为什么中美两国的医疗器械管理会有这么大的差异呢?是不是跟两国的医疗体系、文化背景或者法律法规有关呢?
中美医疗器械管理之所以存在这些不同,主要是受到两国医疗体系、文化背景和法律法规等多方面因素的影响。美国作为医疗器械技术的领先者,其管理体系更加注重创新和市场导向,强调风险分级和全生命周期管理;而中国则更注重医疗器械的安全性和有效性,强调注册备案和事中事后监管。此外,两国的法律法规体系、监管机构的设置和职责分工也存在差异。这些因素共同导致了中美医疗器械管理的不同。了解这些差异,有助于我们更好地把握两国医疗器械市场的特点和趋势。如果您想深入了解中美医疗器械管理的异同,欢迎预约我们的专业演示。
中美医疗器械管理差异对医疗器械企业有何影响?
我是一名医疗器械企业的负责人,想知道中美医疗器械管理的差异会对我们的业务产生什么影响?比如市场准入、产品研发等方面。
中美医疗器械管理的差异对医疗器械企业确实会产生重要影响。在市场准入方面,美国的市场准入门槛相对较高,但一旦获得批准,产品将更容易进入全球市场;而中国则注重注册备案和事中事后监管,企业需要按照中国的法规要求进行产品注册和备案。在产品研发方面,美国鼓励创新和技术突破,对医疗器械的研发和上市提供了较为宽松的环境;而中国则更注重产品的安全性和有效性,对医疗器械的研发和上市进行了严格的监管。这些差异使得医疗器械企业需要根据不同市场的特点制定相应的策略。如果您想了解如何在中美医疗器械市场中脱颖而出,不妨点击我们的免费咨询链接,获取更多专业建议。
中美医疗器械管理未来趋势如何?
随着全球医疗器械市场的不断发展,我想知道中美医疗器械管理的未来趋势会是怎样的?会不会有更多的融合和合作呢?
中美医疗器械管理的未来趋势确实值得关注。随着全球医疗器械市场的不断发展和技术的不断进步,两国在医疗器械管理上的合作和交流将会更加频繁和深入。一方面,美国可能会更加注重产品的安全性和有效性监管,与中国在医疗器械注册备案、事中事后监管等方面进行更多的合作;另一方面,中国也可能会借鉴美国的创新和市场导向理念,推动医疗器械产业的转型升级。此外,两国在医疗器械法规更新、技术标准制定等方面也将加强沟通和协调。这些趋势将使得中美医疗器械管理更加完善和规范。如果您想了解更多关于中美医疗器械管理未来趋势的信息,不妨关注我们的行业动态板块。
免责申明:本文内容通过 AI 工具匹配关键字智能整合而成,仅供参考,伙伴云不对内容的真实、准确、完整作任何形式的承诺。如有任何问题或意见,您可以通过联系 12345@huoban.com 进行反馈,伙伴云收到您的反馈后将及时处理并反馈。