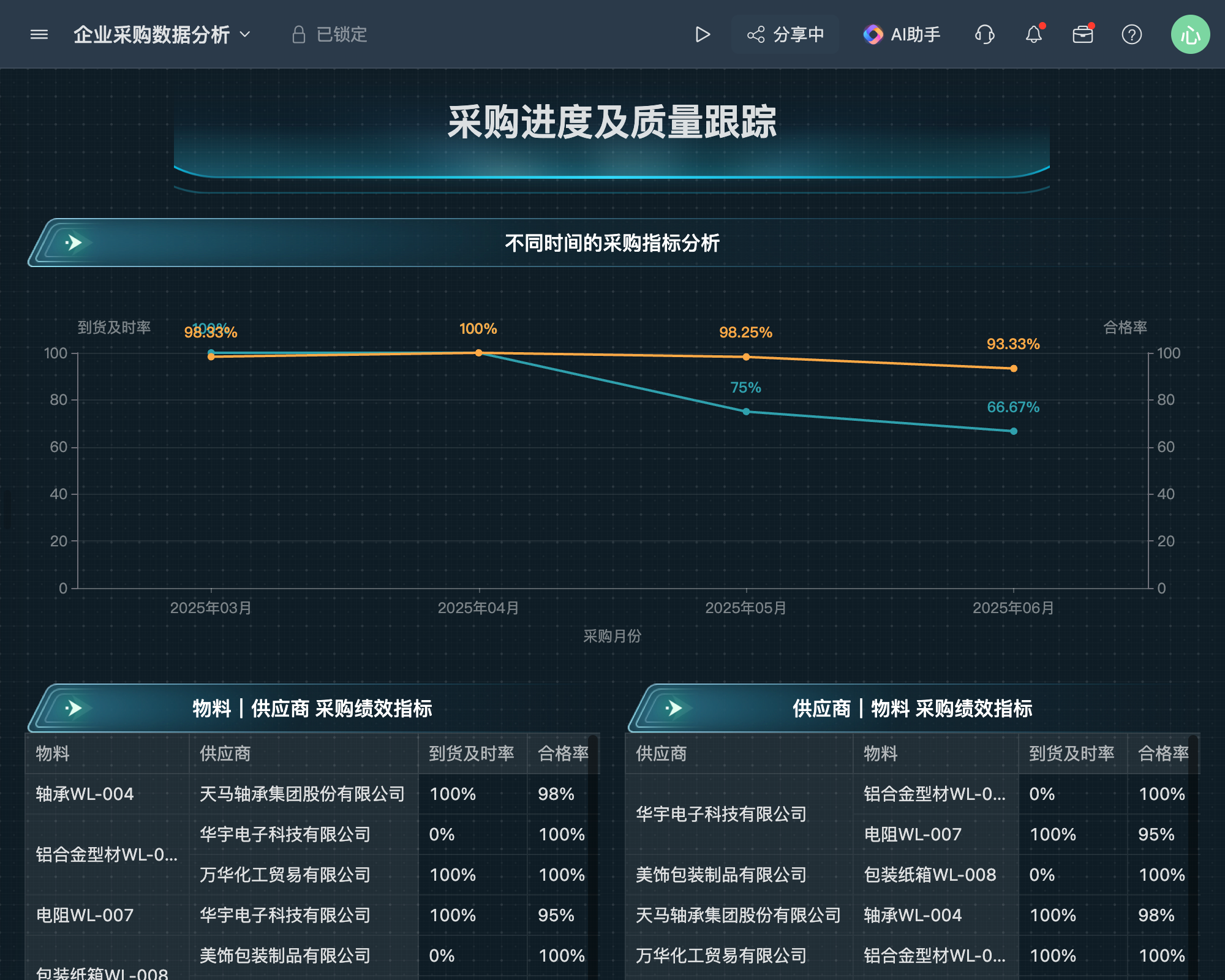
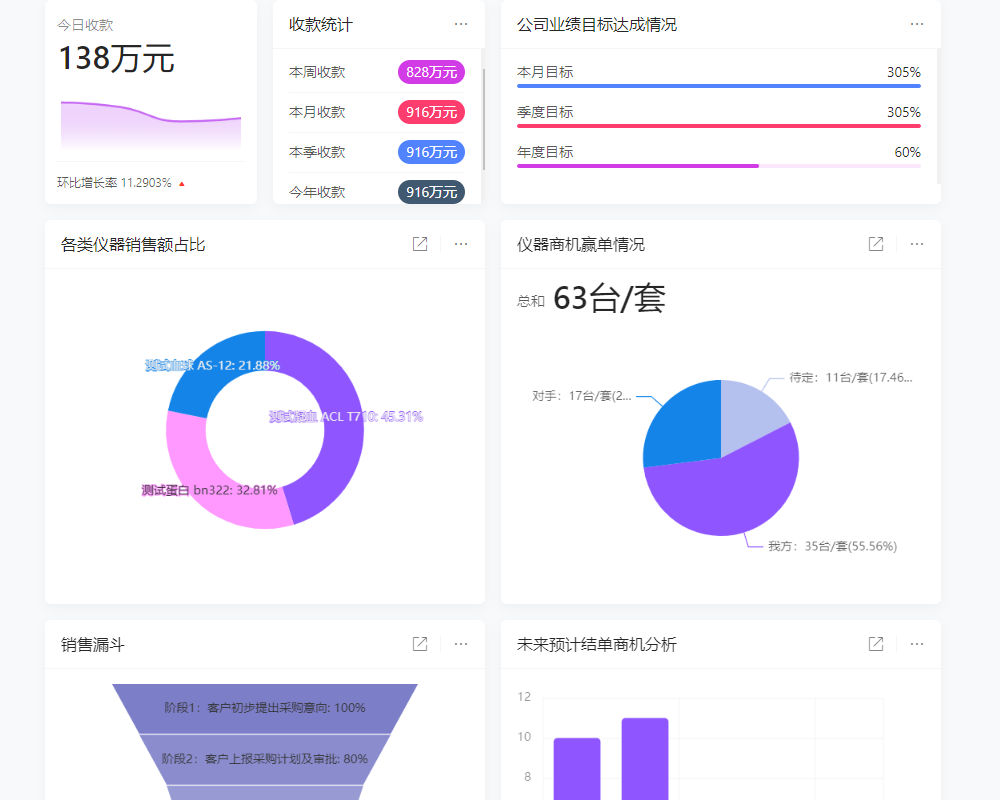
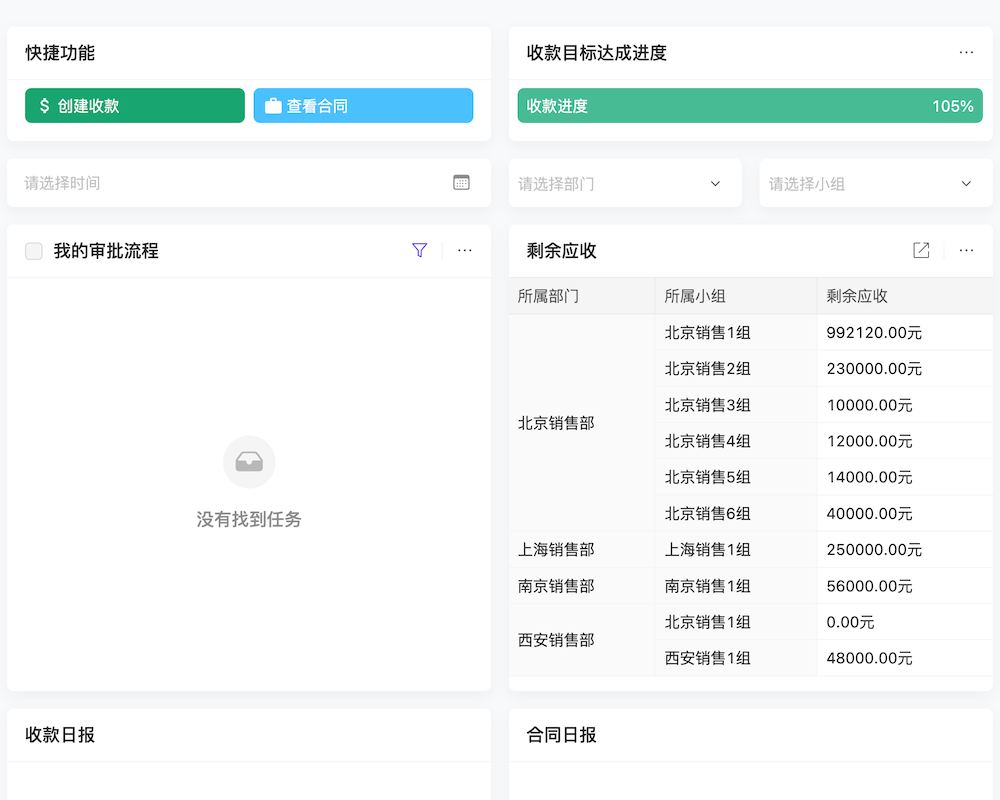
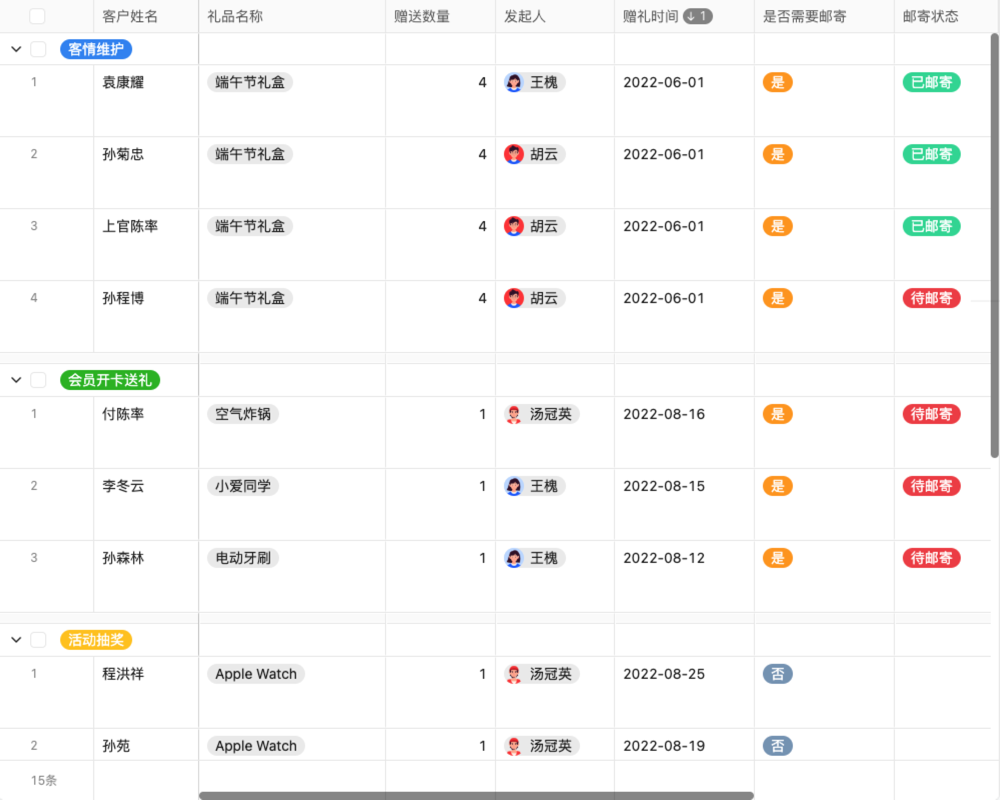
目录
医疗器械风险管理的评审:全面解析其意义、流程与参与者
医疗器械风险管理的评审关系重大,它涉及患者安全、医疗质量、法规合规等多方面。想知道评审流程怎样?从风险识别、分析、评价到控制环环相扣。还有哪些参与者?制造商、医疗机构、监管机构各担何责?这里为你全面解读,快来深入了解医疗器械风险管理评审背后的故事吧。
用户关注问题
医疗器械风险管理评审有哪些流程?
就是说啊,我们公司要做医疗器械这一块,涉及到风险管理评审,我都不知道从哪下手,这个评审到底有啥流程呢?就好比盖房子得知道先打地基再砌墙一样,这个评审得咋个顺序来啊?
医疗器械风险管理评审一般有以下流程:首先是风险识别阶段,这就像是给隐患“点名”,要全面地找出医疗器械在整个生命周期中可能存在的风险,包括设计、生产、使用、维护等环节。比如说,对于一款心脏起搏器,在设计时就要考虑电池续航不足、信号传输故障等风险。
接着是风险分析,这个时候要对识别出来的风险进行定性或者定量分析,评估风险发生的可能性和危害程度,可以用一些工具,像风险矩阵等。例如,如果电池续航不足这个风险发生概率较高,而且一旦发生会对患者生命造成严重威胁,那这就是高风险。
然后是风险评价阶段,确定风险是否可接受。这需要结合法律法规、行业标准以及企业内部的风险接受准则来判断。如果风险不可接受,就要采取措施降低风险。
最后是风险控制措施的实施和评审,看看采取的措施是不是真的把风险降到了可接受的水平。这一系列流程都是为了确保医疗器械的安全性和有效性。如果您想深入了解更多关于医疗器械风险管理评审的细节,欢迎点击免费注册试用我们的相关服务哦。

谁能进行医疗器械风险管理的评审?
咱这医疗器械的风险管理评审,不是随随便便就能搞的吧?总得有人专门负责或者有资格去做这个事儿,到底啥样的人或者机构能干这个活儿呢?就像裁判得有裁判证才能执法比赛一样。
医疗器械风险管理评审通常由多方面的人员或团队参与。首先是企业内部的专业人员,比如医疗器械的研发工程师,他们对产品的技术原理、设计结构最了解,能够从技术角度识别和分析风险。质量管理人员也起着重要作用,他们熟悉质量管理体系,能够确保风险评审过程符合相关标准和法规要求。
另外,外部的专家或者第三方检测机构也可能参与其中。外部专家具有丰富的行业经验和专业知识,能提供客观中立的意见。第三方检测机构则可以依据国家和国际标准,对医疗器械进行全面检测评估。
从SWOT分析来看,企业内部人员的优势在于对产品的深入了解,但可能存在视野不够开阔的劣势;而外部人员和机构的优势是独立性和专业性强,但可能缺乏对企业特殊情况的了解。综合来说,多方共同参与评审是比较理想的方式。如果您希望获取更专业的医疗器械风险管理评审服务,欢迎预约演示我们的解决方案。
医疗器械风险管理评审多久做一次?
这个医疗器械风险管理评审,不能做一次就不管了吧?那得隔多久再做一次呢?就像汽车保养似的,有个固定的时间周期,这个评审是不是也这样呢?
医疗器械风险管理评审的周期不是固定不变的,它受到多种因素影响。
如果医疗器械有重大设计变更,例如从传统的金属材质改为新型的复合材料,这时候就需要立即进行风险管理评审,因为这种改变可能带来新的风险。
当出现新的法规要求时,也需要及时进行评审。比如新出台了关于医疗器械电磁兼容性的严格法规,企业就得重新审视产品风险。
另外,在市场反馈有不良事件发生时,如某医疗器械在使用过程中频繁出现故障报警,这也是触发风险管理评审的时机。
正常情况下,定期评审也是必要的,对于一些高风险的医疗器械,可能每年都需要进行一次全面的评审;低风险的医疗器械,可能每2 - 3年评审一次。不过这只是大致的参考,具体还要根据实际情况确定。如果您想要定制适合自己企业医疗器械的风险管理评审计划,欢迎点击免费注册试用我们的定制服务。
免责申明:本文内容通过 AI 工具匹配关键字智能整合而成,仅供参考,伙伴云不对内容的真实、准确、完整作任何形式的承诺。如有任何问题或意见,您可以通过联系 12345@huoban.com 进行反馈,伙伴云收到您的反馈后将及时处理并反馈。
热门场景应用