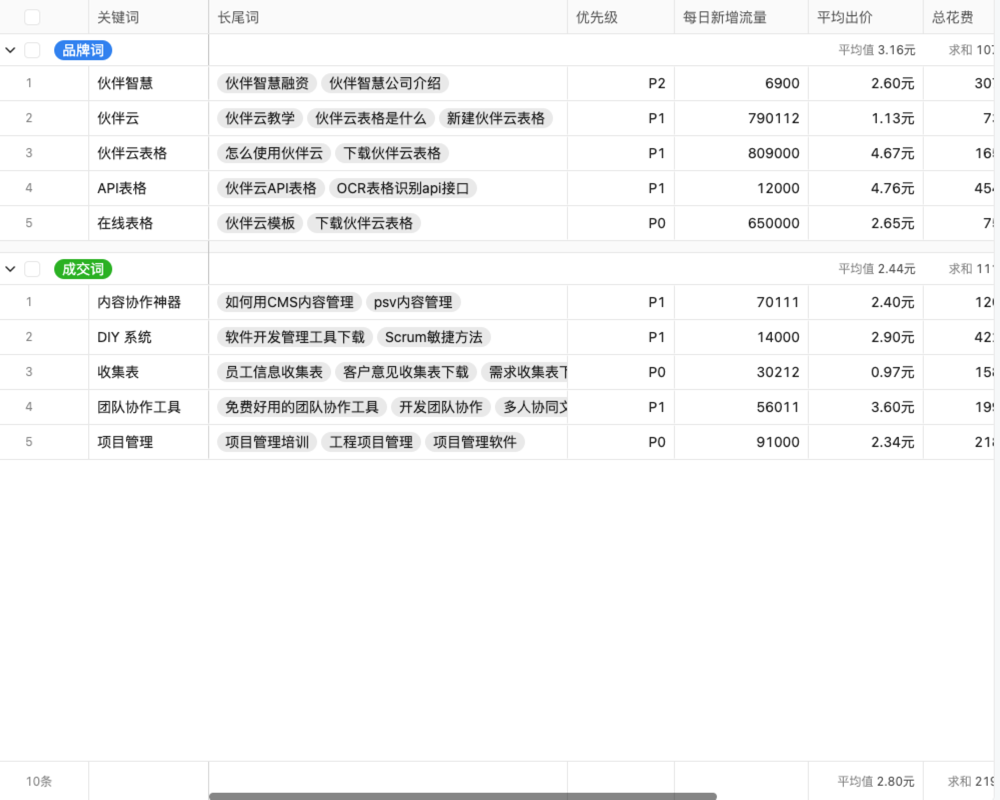
目录
如何精准理解医疗器械监督管理类别?全面解析在此!
医疗器械的安全性和有效性至关重要,了解医疗器械监督管理类别是关键。本文详细解析了低风险、中风险、高风险医疗器械的监督管理要求,以及从生产企业、监管机构、消费者三个角度的实际应用。同时,探讨未来趋势,助您更好应对监管挑战。文末还有免费试用专业医疗器械管理系统的机会,快来了解吧!
用户关注问题
医疗器械监督管理类别有哪些?
嘿,我在医疗器械行业工作,最近想了解下我们产品的监管类别,能告诉我医疗器械监督管理类别具体是怎么划分的吗?
医疗器械监督管理类别主要根据医疗器械的风险程度进行划分,通常分为三类:I类、II类、III类。I类医疗器械风险较低,如部分外科手术器械、听诊器等,实行常规管理;II类医疗器械具有中度风险,如血压计、体温计等,需要严格控制生产质量;III类医疗器械风险最高,如植入式心脏起搏器、人工关节等,需要采取特别措施严格控制其安全性与有效性。了解您产品的具体类别对于合规生产和销售至关重要,如果您需要更详细的指导,不妨点击免费注册试用我们的医疗器械管理软件,它能帮助您轻松管理不同类别的医疗器械。

如何确定医疗器械的监督管理类别?
我是一名医疗器械生产商,想知道怎么准确判断我们新研发的产品属于哪一类监督管理类别?
确定医疗器械的监督管理类别,通常需要参考国家药品监督管理局(NMPA)发布的医疗器械分类目录。您可以根据产品的预期用途、结构特征、使用风险等因素进行初步判断。如果仍不确定,建议咨询专业机构或向NMPA申请分类界定。在判断过程中,还需注意不同国家和地区可能有不同的分类标准。为了帮助您更高效地管理这一过程,预约我们的演示服务,我们将展示如何通过智能化工具快速准确地进行医疗器械分类。
不同监督管理类别的医疗器械有哪些监管要求?
我想知道,I类、II类、III类医疗器械在注册、生产、销售等环节上,各自的监管要求有什么不同?
不同监督管理类别的医疗器械在监管要求上确实存在显著差异。I类医疗器械相对简单,主要进行备案管理;II类医疗器械需要注册审批,并遵循更严格的生产质量管理体系;III类医疗器械则面临更为严格的注册审批流程、生产现场检查以及上市后监管。此外,各类别在标签标识、说明书撰写、不良事件监测等方面也有不同要求。了解并遵守这些规定对于保障医疗器械的安全有效至关重要。若您希望深入了解并优化您的合规流程,不妨点击免费注册试用我们的合规管理软件。
医疗器械监督管理类别的变更流程是怎样的?
如果我们的医疗器械产品需要调整监督管理类别,比如从II类升级到III类,需要走哪些流程?
医疗器械监督管理类别的变更通常涉及产品注册信息的更新和重新审批。具体流程包括:向NMPA提交变更申请,提供产品升级或变更的相关证明文件;NMPA对申请进行审核,必要时进行现场检查;审核通过后,颁发新的注册证或更新原有注册信息。在此过程中,您可能需要与专业机构合作,以确保申请材料的准确性和完整性。为了帮助您顺利完成这一过程,预约我们的咨询服务,我们将为您提供专业的指导和支持。
免责申明:本文内容通过 AI 工具匹配关键字智能整合而成,仅供参考,伙伴云不对内容的真实、准确、完整作任何形式的承诺。如有任何问题或意见,您可以通过联系 12345@huoban.com 进行反馈,伙伴云收到您的反馈后将及时处理并反馈。
热门场景应用