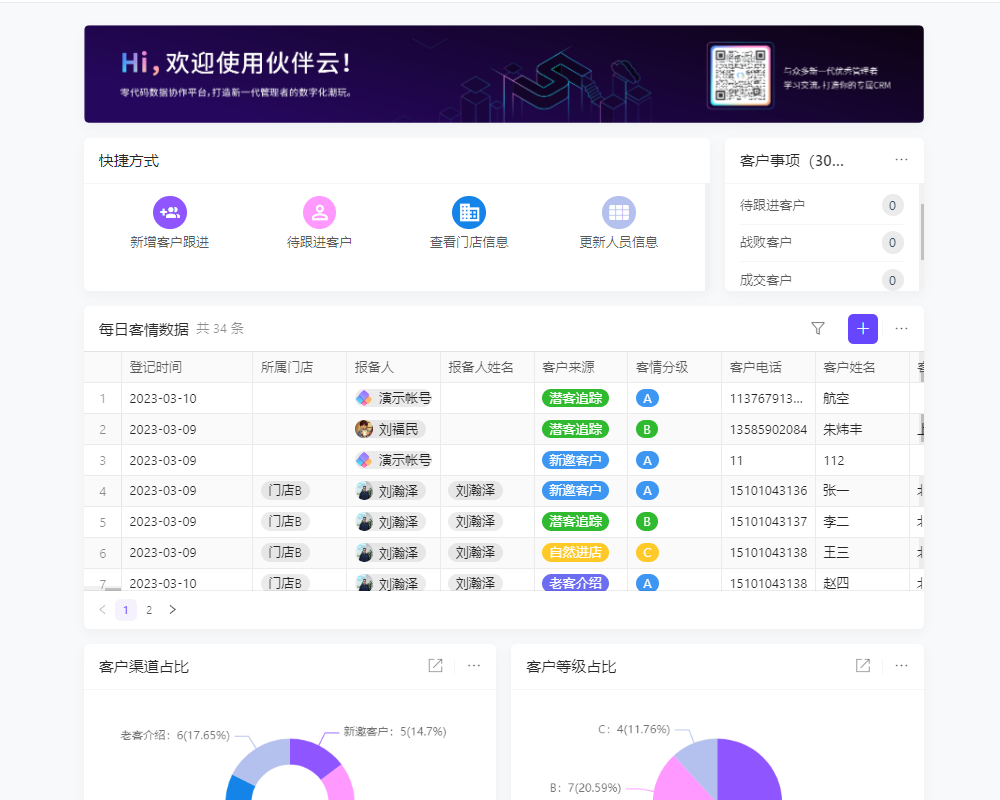
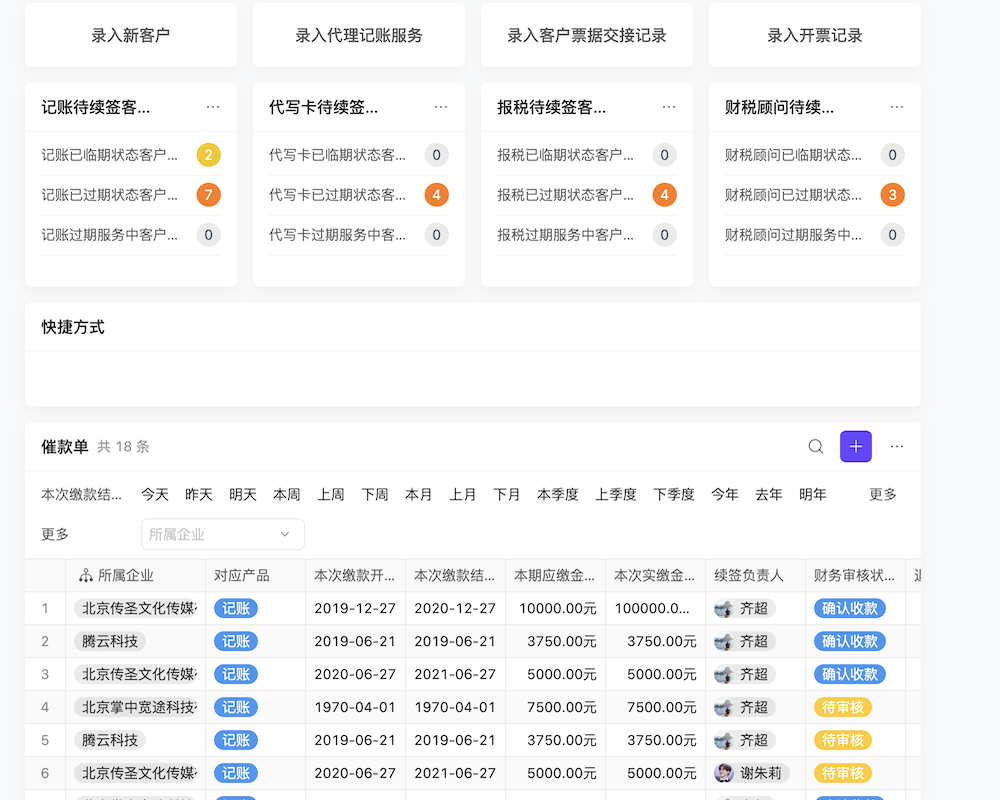
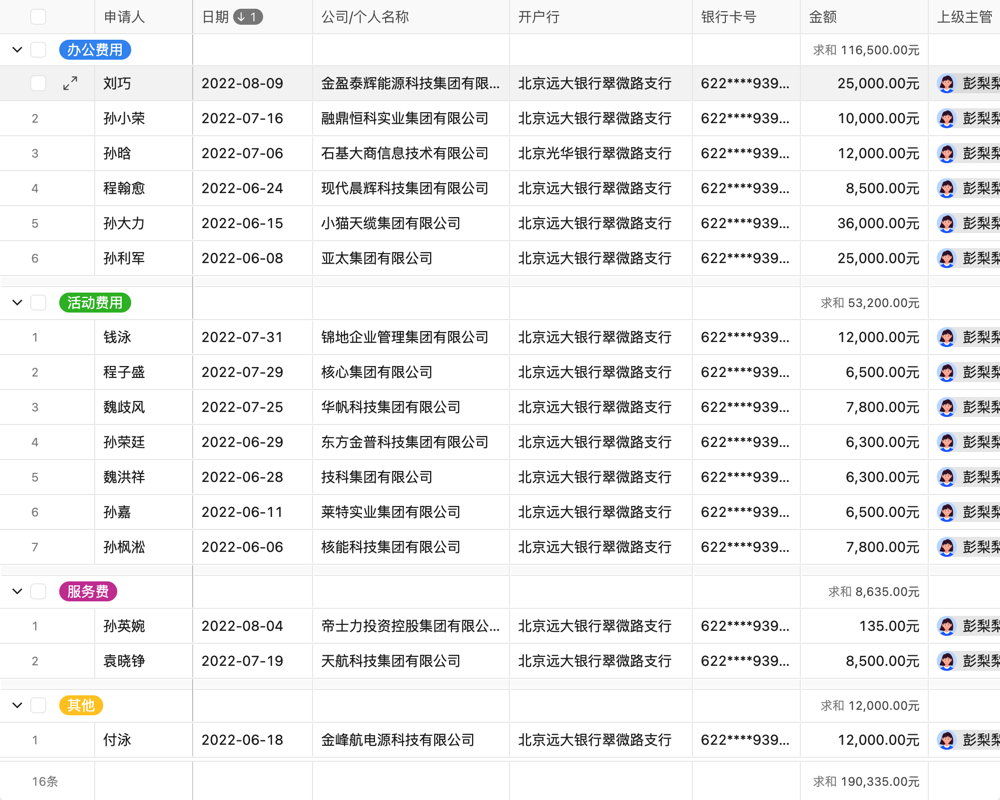
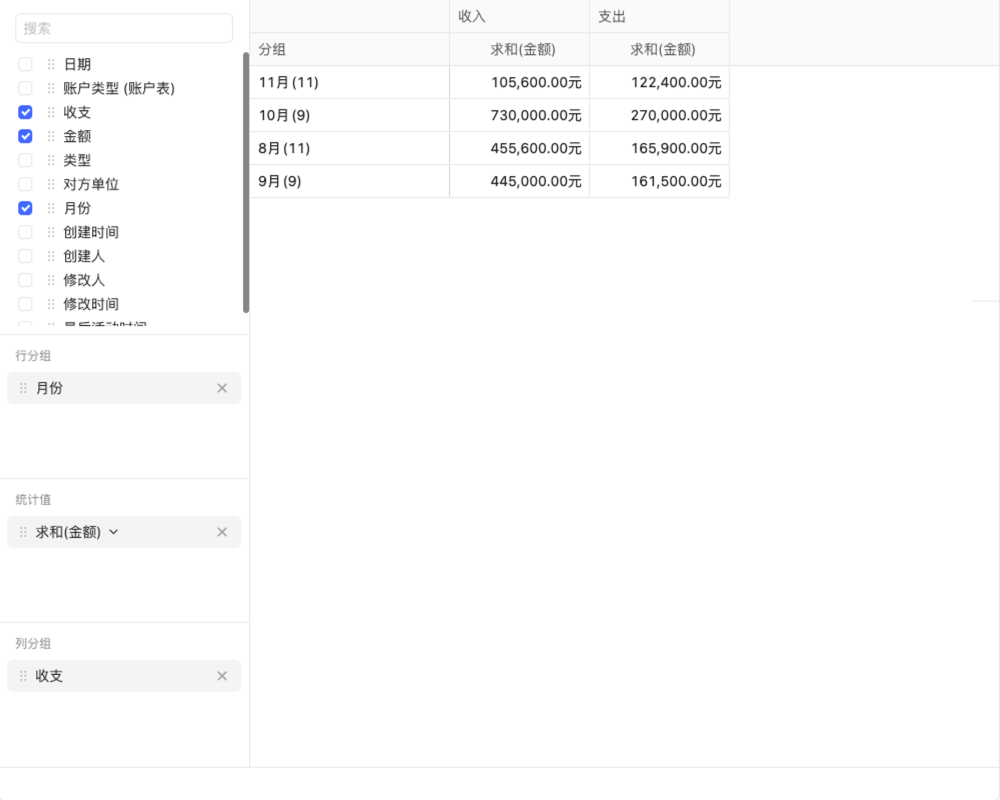
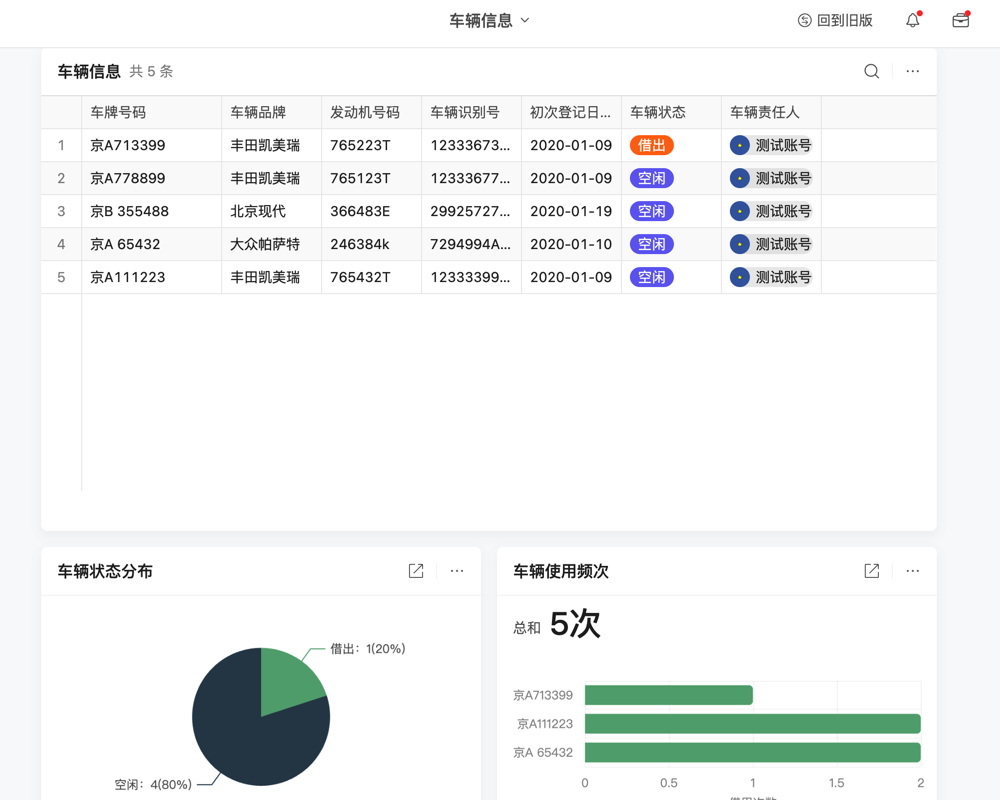
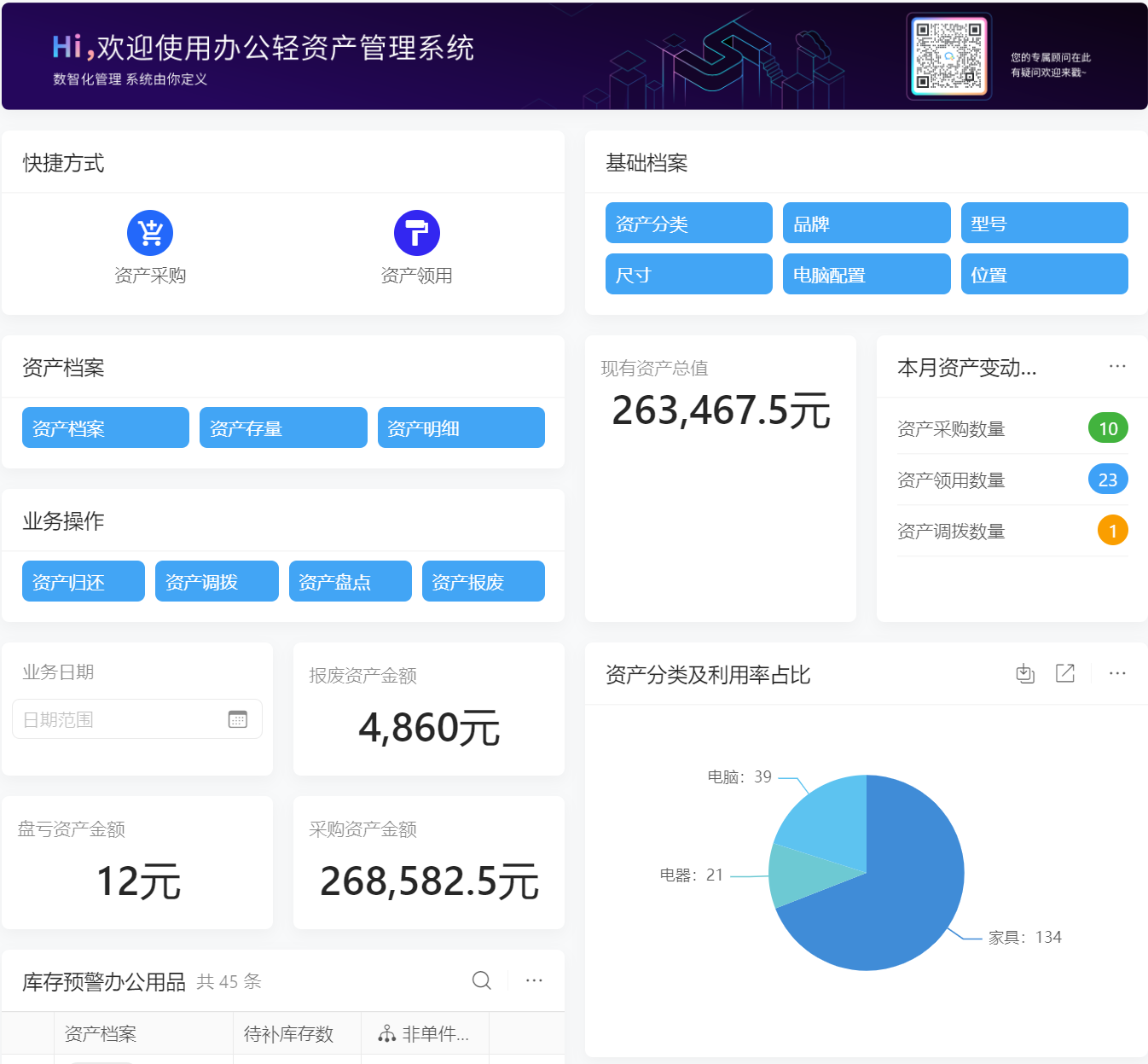
目录
全面解析:中外医疗器械管理标准有何异同?
在当今全球化的医疗环境中,中外医疗器械管理标准扮演着至关重要的角色。本文将从概述、主要差异、融合与互认、对企业的影响及如何应对变化等多个维度,全面深入解析中外医疗器械管理标准的现状与趋势,带您领略这一领域的精彩全貌。
用户关注问题
中外医疗器械管理标准有哪些主要差异?
嘿,你知道吗?不同国家对于医疗器械的管理可是有很大不同的哦!我就想问问,中外在医疗器械管理标准上,到底有哪些主要的差异呢?
中外医疗器械管理标准确实存在显著差异,这主要体现在法规体系、审批流程、市场监管以及产品分类等方面。首先,中国的医疗器械管理遵循《医疗器械监督管理条例》等法规,而国外如美国则依据FDA(食品药品监督管理局)的相关规定。其次,审批流程上,中国实行注册与备案制,而美国则通过510(k)、PMA等路径进行。此外,市场监管力度和产品分类标准也存在不同。这些差异使得中外医疗器械在安全性、有效性评估上有所不同。对于想要进军国际市场的企业,了解并适应这些差异至关重要。点击这里免费注册试用我们的医疗器械管理软件,助您轻松应对各国管理标准。

国外医疗器械管理标准中,哪些对中国企业有借鉴意义?
我看好多中国企业都在学习国外的医疗器械管理标准,说是能提升产品质量和竞争力。那到底国外有哪些管理标准是值得咱们中国企业借鉴的呢?
国外医疗器械管理标准中,确实有不少值得中国企业借鉴的地方。例如,美国FDA的严格审批流程和风险管理机制,能够确保医疗器械的安全性和有效性;欧盟的CE认证体系则强调产品的合规性和市场准入;日本的PMDA则注重产品的临床性能和用户反馈。中国企业可以借鉴这些标准中的先进理念和方法,如加强风险管理、完善审批流程、提升产品合规性等,从而提升自身产品质量和竞争力。同时,结合中国国情和市场需求,进行本土化创新。点击这里预约演示我们的医疗器械合规解决方案,了解更多国外管理标准的实践经验。
中国医疗器械管理标准是如何与国际接轨的?
随着全球化进程的加快,中国的医疗器械管理标准也在不断更新和完善。我就想问问,中国是如何让自家的医疗器械管理标准与国际接轨的呢?
中国医疗器械管理标准与国际接轨的过程是一个持续不断的努力。一方面,中国积极借鉴国际先进标准,如ISO 13485医疗器械质量管理体系等,将其融入国内法规体系;另一方面,中国也加强与国际组织的合作与交流,如参与ISO、IEC等国际标准的制定和修订工作。此外,中国还通过建立互认机制、推动注册备案制度的改革等方式,促进国内外医疗器械市场的互联互通。这些措施使得中国医疗器械管理标准更加符合国际要求,为国内外企业提供了更加公平、透明的市场环境。点击这里了解我们的医疗器械国际认证服务,助您轻松跨越国际门槛。
中外医疗器械管理标准对企业有哪些具体影响?
都说中外医疗器械管理标准不同,那这些差异对企业来说,到底会产生哪些具体的影响呢?是成本上升了,还是市场竞争力下降了?
中外医疗器械管理标准对企业的影响是多方面的。一方面,企业需要投入更多资源来满足不同国家的管理要求,如进行多次注册备案、进行额外的质量检测等,这可能导致成本上升。另一方面,严格的管理标准也促使企业提升产品质量和合规性水平,从而增强市场竞争力。此外,不同国家的管理标准还可能影响企业的市场准入和销售渠道。因此,企业需要充分了解各国管理标准的特点和要求,制定针对性的应对策略。点击这里免费咨询我们的医疗器械管理专家,获取更多关于中外管理标准对企业影响的深度分析。
免责申明:本文内容通过 AI 工具匹配关键字智能整合而成,仅供参考,伙伴云不对内容的真实、准确、完整作任何形式的承诺。如有任何问题或意见,您可以通过联系 12345@huoban.com 进行反馈,伙伴云收到您的反馈后将及时处理并反馈。