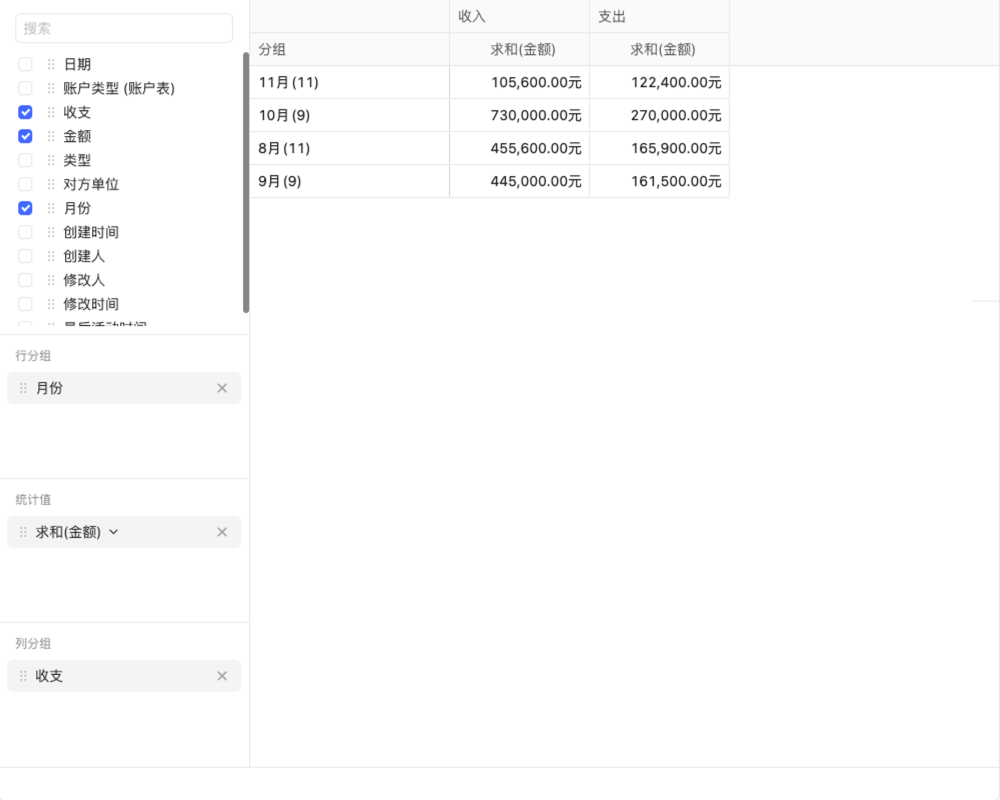
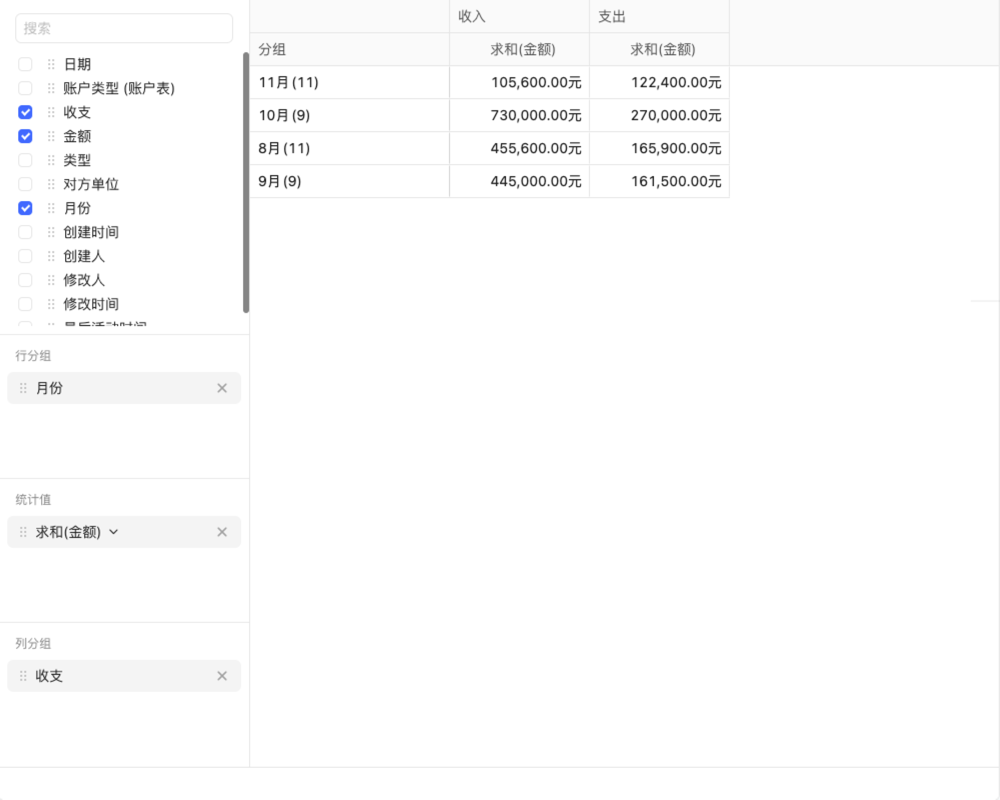
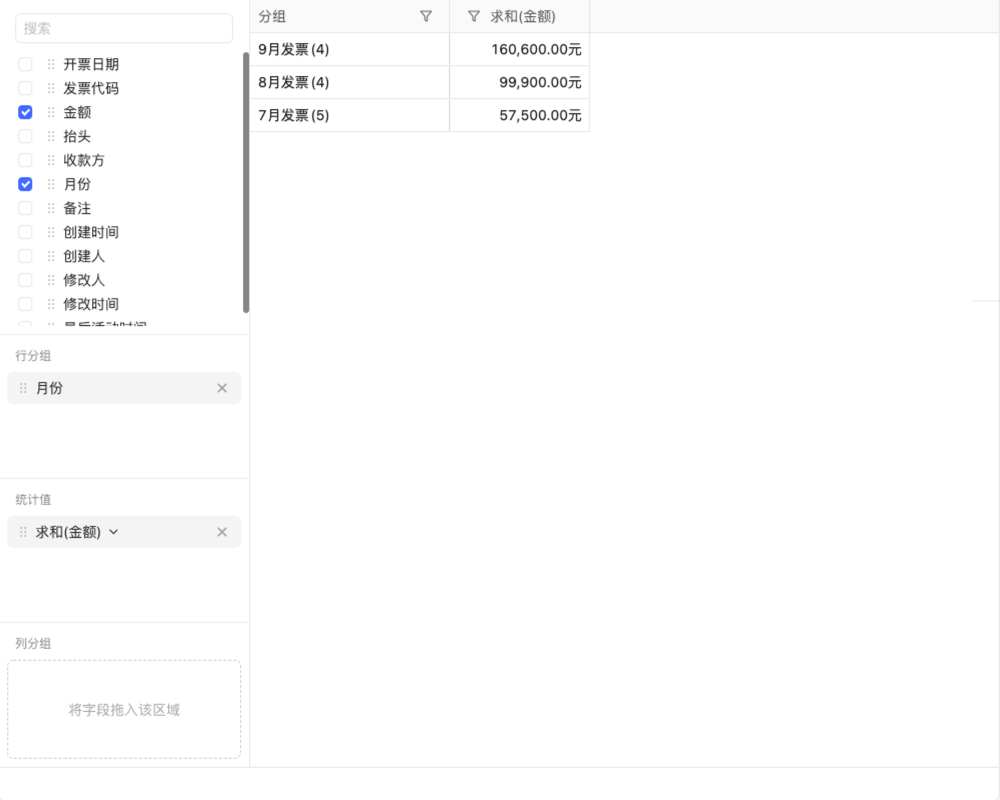
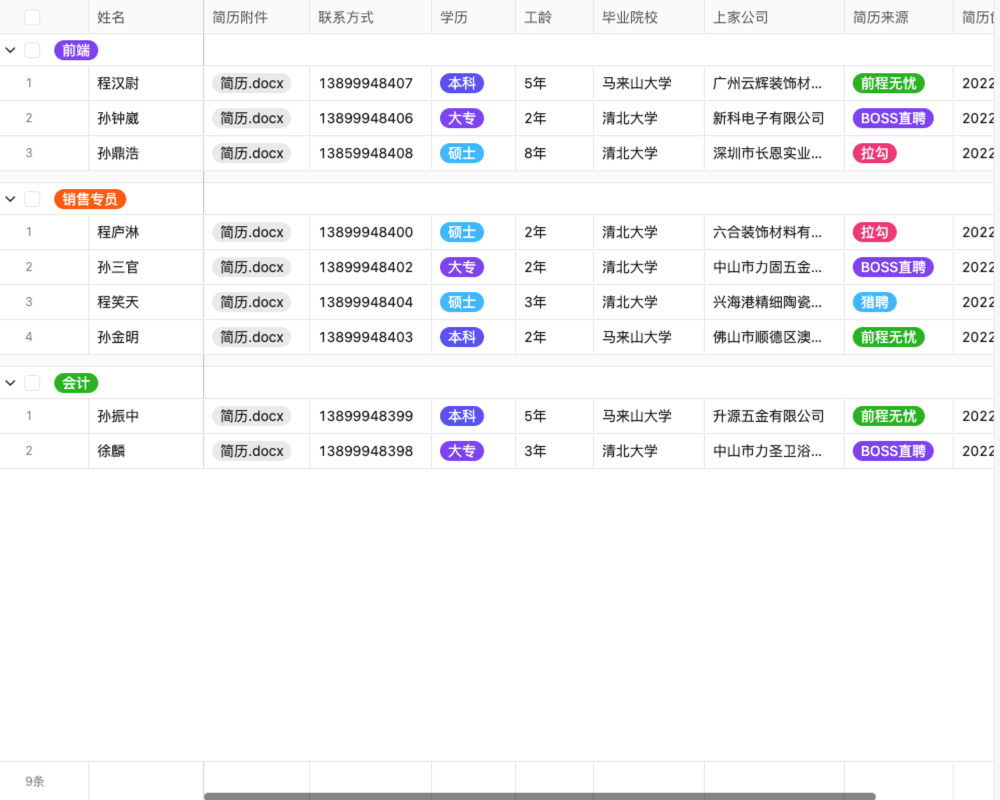
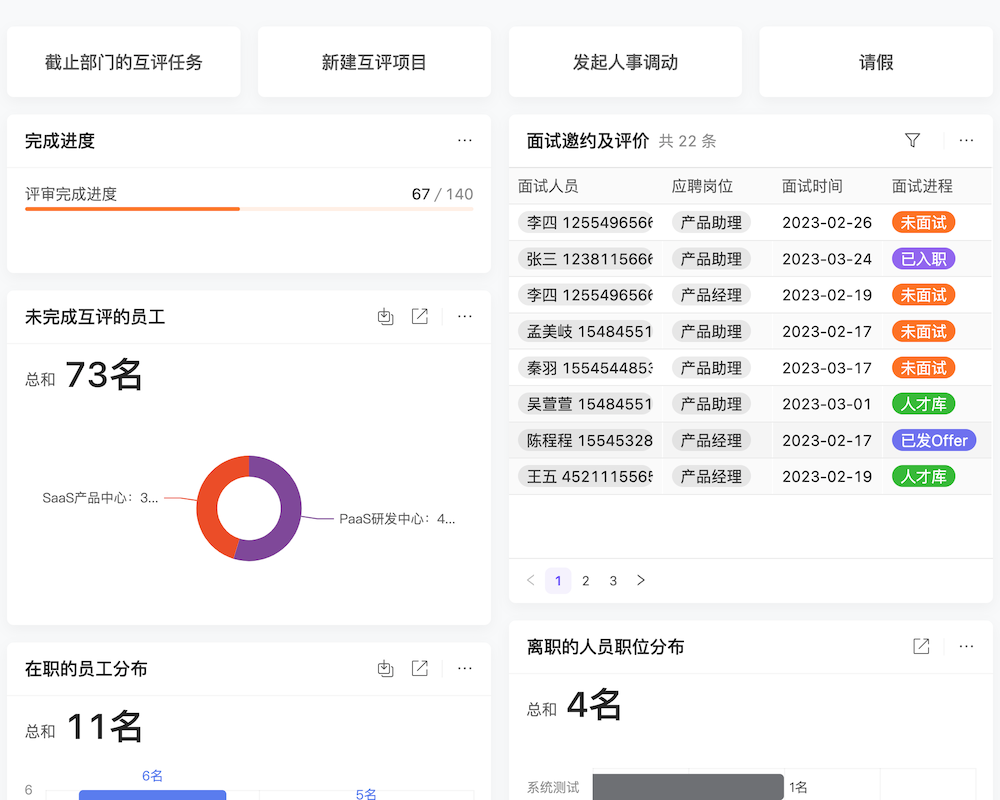
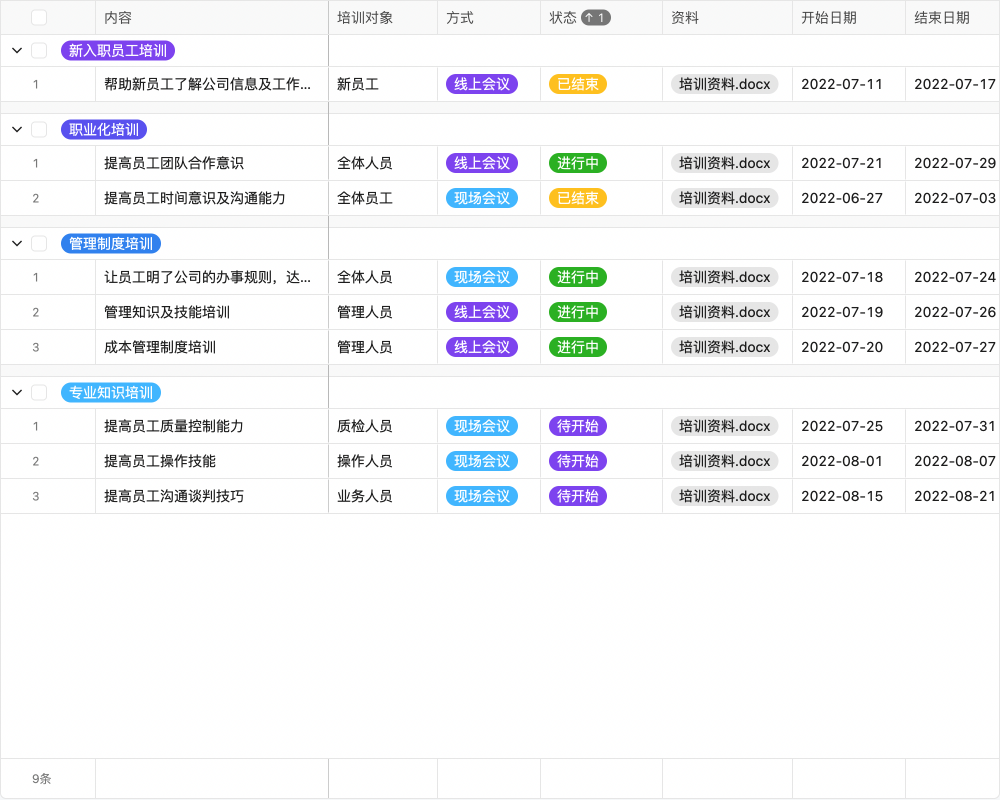
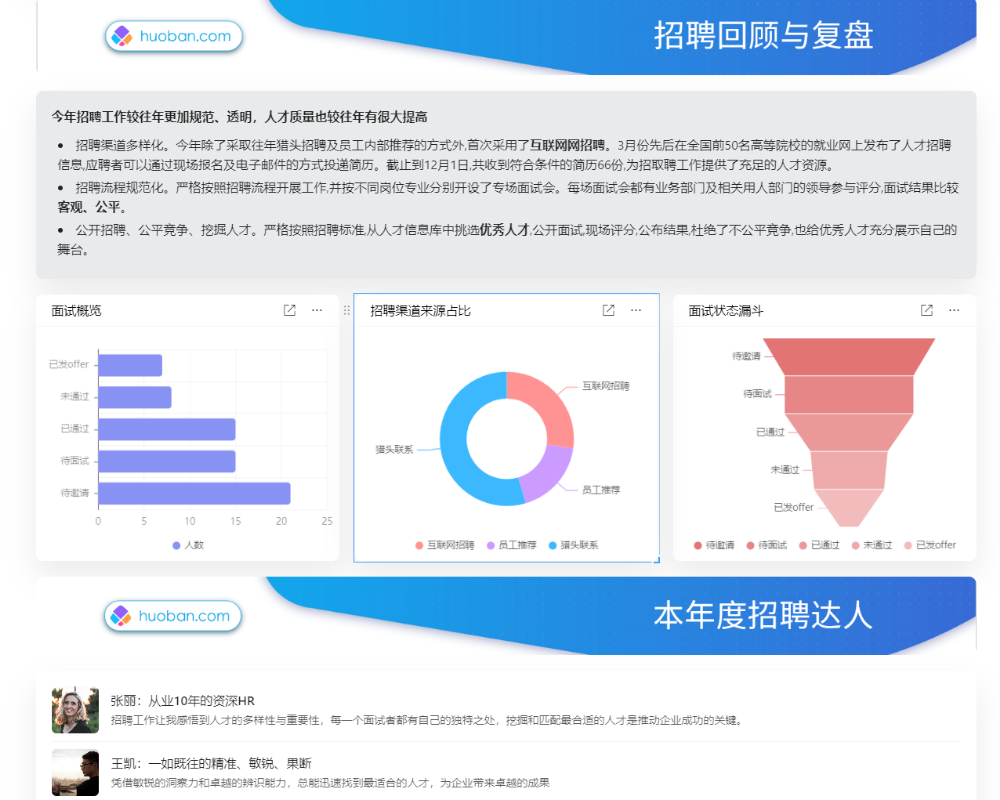
目录
欧洲对医疗器械管理的全面解析与最新动态
深入了解欧洲医疗器械管理的法规体系、分类上市路径、上市后监管及不良事件报告机制。探讨制造商面临的法规合规、数据管理挑战及应对策略,展望欧洲医疗器械管理的数字化转型与国际合作趋势。
用户关注问题
欧洲对医疗器械的管理有哪些主要法规?
想了解在欧洲市场上销售医疗器械,需要遵守哪些主要的法律法规呢?比如有没有像FDA那样的严格监管机构?
欧洲对医疗器械的管理主要依据的是医疗器械法规(MDR)和体外诊断医疗器械法规(IVDR)。这两个法规由欧洲委员会制定,旨在确保在欧洲市场上销售的医疗器械和体外诊断产品的安全性和性能。MDR适用于所有类别的医疗器械,从低风险到高风险,而IVDR则专注于体外诊断产品。这些法规要求制造商进行风险评估、临床评估、注册以及持续监控等,确保产品符合欧洲的健康、安全和环境保护标准。如果您想在欧洲市场销售医疗器械,了解并遵守这些法规是至关重要的。点击此处免费注册试用我们的合规工具,帮助您轻松应对欧洲市场挑战。

如何将医疗器械合规地进入欧洲市场?
假如我是一家医疗器械生产商,想要把产品出口到欧洲,需要走哪些流程才能确保合规上市呢?
将医疗器械合规地进入欧洲市场,需要遵循一系列步骤。首先,您需要对您的产品进行分类,确定其风险等级。接着,根据MDR或IVDR的要求,进行风险评估和临床评估,确保产品的安全性和有效性。然后,准备并提交必要的技术文档给欧洲各国的监管机构进行注册。此外,还需要建立并维护一个质量管理体系,以确保产品的持续合规性。在整个过程中,与专业的法规咨询机构合作,可以大大提高您的合规效率和成功率。想了解更多详情,欢迎预约我们的合规演示。
欧洲医疗器械管理对制造商有哪些具体要求?
作为医疗器械制造商,欧洲市场对我们有哪些具体的要求?比如生产、标签、包装等方面。
欧洲医疗器械管理对制造商的要求非常严格,涵盖了生产、标签、包装等多个方面。在生产方面,制造商需要建立并执行一个符合ISO 13485标准的质量管理体系。标签和包装方面,必须提供清晰、准确的产品信息,包括CE标志、制造商信息、产品分类、使用说明等。此外,制造商还需要进行定期的市场监控和不良事件报告,确保产品的持续安全性和有效性。为了满足这些要求,许多制造商选择与我们这样的专业机构合作,通过我们的合规服务,确保产品顺利进入欧洲市场。
欧洲医疗器械市场的监管趋势是怎样的?
未来几年,欧洲对医疗器械的监管会有什么新的变化或趋势吗?这对于想要进入欧洲市场的企业来说意味着什么?
欧洲医疗器械市场的监管趋势正朝着更加严格和透明的方向发展。随着MDR和IVDR的全面实施,监管机构对产品的安全性和有效性的要求将进一步提高。同时,数字化和远程医疗的兴起也带来了新的监管挑战和机遇。对于企业来说,这意味着需要投入更多的资源和精力来确保产品的合规性,同时积极拥抱新技术,以满足市场需求。我们的合规解决方案可以帮助您紧跟监管趋势,确保您的产品始终符合欧洲市场的最新要求。
免责申明:本文内容通过 AI 工具匹配关键字智能整合而成,仅供参考,伙伴云不对内容的真实、准确、完整作任何形式的承诺。如有任何问题或意见,您可以通过联系 12345@huoban.com 进行反馈,伙伴云收到您的反馈后将及时处理并反馈。